1、选择题 用NA表示阿伏加德罗常数,下列叙述正确的是(?)
A.标准状况下,22.4L H2O含有的分子数为1 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.常温常压下,1 NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol / L的MgCl2溶液中,含有Cl-物质的量浓度为1 mol / L
参考答案:BD
本题解析:考查物质的量的有关计算。标准状况下,水不是气体,不能适用于气体摩尔体积,选项A不正确;1.06g Na2CO3是0.01mol,所以含有0.02mol钠离子,选项B正确;选项C不正确,因为不是在标准状况下;根据氯化镁的化学式可知,0.5mol / L的MgCl2溶液中,含有Cl-物质的量浓度为0.5mol/L×2=1 mol / L,选项D正确,答案选BD。
本题难度:一般
2、填空题 硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.770 0 g样品,配制成100.00 mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42—)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥________mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4—被还原为MnO2,其离子方程式为______________。
(3)通过计算确定样品的组成(写出计算过程)。
参考答案:
本题解析::(1)根据Ksp可得出c(Ba2+)=Ksp/c(SO42—)=1.1×10-10/1.0×10-6=1.1×10-4。(2)根据条件可知,非酸性条件下,MnO4—被还原为MnO2,则H2O2被氧化,氧化产物只能为O2,根据得失电子守恒,确定出MnO4—和H2O2的系数,再根据电荷守恒,确定出产物中含有OH-。(3)由②组数据可知沉淀为BaSO4,根据S元素守恒,可得n(Na2SO4)=n(BaSO4)=2.50×10-3 mol;由③组数据,再结合反应2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2↑可得出n?H2O2?=1.25×10-3 mol;再根据样品的质量,通过质量的关系得出样品中H2O的质量,进一步得出n?H2O?=2.50×10-3 mol;故x∶y∶z=n?Na2SO4?∶n?H2O2?∶n?H2O?=2∶1∶2。所以,硫酸钠?过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O。
答案:?1?1.1×10-4
?2?2MnO4—+3H2O2=2MnO2+3O2+2OH-+2H2O
(3)n(Na2SO4)=n(BaSO4)=0.5825/233=2.50×10-3 mol
2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2
n(H2O2)=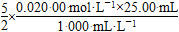 =1.25×10-3 mol
=1.25×10-3 mol
m(Na2SO4)=142 g·mol-1×2.50×10-3 mol=0.355 g
m(H2O2)=34 g·mol-1×1.25×10-3 mol=0.042 5 g
n(H2O)=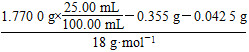 =2.50×10-3 mol
=2.50×10-3 mol
x∶y∶z=n(Na2SO4)∶n(H2O2)∶n(H2O)=2∶1∶2
硫酸钠?过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
本题难度:一般
3、选择题 MgSO4和Al2(SO4)3溶液等体积混合后,铝离子的物质的量浓度为0.1mol/L,硫酸根离子的浓度为0.3mol/L,则混合液中镁离子的浓度为
[? ]
A.0.15mol/L
B.0.3mol/L
C.0.45mol/L
D.0.2mol/L
参考答案:A
本题解析:
本题难度:一般
4、选择题 设NA为阿伏加德罗常数,下列叙述中正确的是(?)
A.标准状况下,1.12L的SO3所含的原子数约为0.2NA
B.1 mol Na2O2中所含的阴离子数约为2NA
C.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
D.1L0.1mol·L-1Na2CO3溶液中含有0.1NA个CO32—
参考答案:C
本题解析:标准状况下,三氧化硫不是气体,不能适用于气体摩尔体积,A不正确;过氧化钠中阳离子和阴离子的个数之比是2︰1,所以选项B中所含的阴离子数约为NA;S2和S8都是S元数的不同单质,6.4g混合物中含有0.2molS原子,C正确;碳酸钠在溶液中CO32-水解,所以D中含有的CO32—个数小于0.1NA,D不正确,答案选C。
本题难度:一般
5、选择题 混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
A.1:1
B.1:4
C.4:1
D.1:2