1、计算题 有以下四种物质:①22 g二氧化碳②8 g氢气③1.2×10 个氮气分子④4 ℃时18 mL水。它们所含分子数最多的是 ,所含原子数最多的是 ,质量最大的是 ,所含电子数最多的是 (填序号)
个氮气分子④4 ℃时18 mL水。它们所含分子数最多的是 ,所含原子数最多的是 ,质量最大的是 ,所含电子数最多的是 (填序号)
参考答案:② ② ③ ③
本题解析:4 ℃时,水的密度为1 g·mL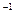 !
!
注意物质的量在各种量之间换算时的“桥梁”作用。计算过程中使用物质的量,可实现将各种量进行快速换算的目的。
物质的量相同的粒子,其个数是相同的,故分子数最多的物质,就是物质的量最大的物质。
(1)各物质的物质的量为:
①
②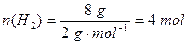
③
④
所含分子数最多的是②。
(2)所含原子数的物质的量分别为:
①n="0.5" mol×3="1.5" mol
②n="4" mol×2="8" mol
③n="2" mol×2="4" mol
④n="1" mol×3=" 3" mol
所含原子数最多的是②。
(3)各物质的质量:
①22 g ②8 g ③28 g·mol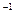 ×2 mol="56" g ④18 g
×2 mol="56" g ④18 g
质量最大的是③。
(4)各物质所含电子数:
①n="0.5" mol×(6+8×2)="11" mol
②n="4" mol×2×1="8" mol
③n="2" mol×2×7="28" mol
④n="1" mol×(2+8)="10" mol
所含电子数最多的是③。
本题难度:一般
2、填空题 (14分)实验室欲配制0.5mol/L的NaOH溶液500ml有以下仪器:
①烧杯 ②100ml量筒 ③100ml容量瓶 ④500ml容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有___________(填代号),还缺少的仪器是_____ _____。该试验中两次用到玻璃棒,其作用分别是_______ ________,_________________。
(2)使用容量瓶前必须进行的一步操作是_____________________。
(3)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为_____________________________________________。(填代号)
(4)在配制过程中,其他操作都正确的,下列操作会引起误差偏高的是__________。
①没有洗涤烧杯和玻璃棒
②未等NaOH溶液冷却至室温就转移到容量中
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视标线 ⑤定容时仰视标线
参考答案:29.(1)①④⑤⑥ ; 胶头滴管 ; 加速溶解 ; 引流
(2)检查是否漏液(水) (3)②①③⑧⑤⑥⑦④ (4)②④
本题解析:(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有托盘天平、烧杯、500ml的容量瓶、胶头滴管、药匙,(1)配制时,必须使用的仪器有①④⑤⑥, 还缺少的仪器是胶头滴管; 该试验中两次用到玻璃棒,其作用分别是, 加速溶解、引流;
(2)因为最后需颠倒摇匀,所以容量瓶在使用前必须检查是否漏水.答案为:检查容量瓶是否漏水;
(3)配制溶液时,正确的操作顺序为②①③⑧⑤⑥⑦④;
(4)①没有洗涤烧杯和玻璃棒,导致溶质质量减少,所配溶液浓度偏低;②未冷却到室温就将溶液转移到容量瓶并定容,温度恢复室温后,会导致溶液体积偏小,溶液浓度偏高;③容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;④定容时俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高;⑤定容时仰视标线,导致溶液体积偏大,所配溶液浓度偏低.选:②④。
考点:考查一定物质的量浓度溶液的配制。
本题难度:一般
3、选择题 以下有关物质的质量分数和物质的量浓度的叙述正确的是
A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1
B.Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10%
D.20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0 mol?L-1,则此溶液中KCl的质量分数为 ×100%
×100%
参考答案:D
本题解析:A项,由生成硫酸钡沉淀的质量相等,即生成硫酸钡的物质的量相等,说明各溶液中含有相量物质的量的SO42-,设溶液中含有的物质的为1 mol,则有Fe2(SO4)3  mol、CuSO41 mol、K2SO41 mol,故浓度之比为
mol、CuSO41 mol、K2SO41 mol,故浓度之比为 ?: 1 : 1="1" : 3 : 3,A项错误。B项,Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的体积不相同,则物质的量浓度不相等,B项错误。C项中,若两种氨水等体积混合,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于10%,C项错。20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,根据c=
?: 1 : 1="1" : 3 : 3,A项错误。B项,Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的体积不相同,则物质的量浓度不相等,B项错误。C项中,若两种氨水等体积混合,浓的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,所得氨水溶液的质量分数小于10%,C项错。20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,根据c= 可知,质量分数为w=
可知,质量分数为w= ?×100%,故D正确;
?×100%,故D正确;
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.0.1molOH—含0.9NA电子
B.1.8g重水((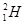 2O)中含NA个中子
2O)中含NA个中子
C.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
参考答案:C
本题解析:A错,0.1molOH—含NA个电子;B错,1.8g重水((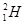 2O)中含中子数小于NA个;C正确;D错,标准状况下水不是气体;
2O)中含中子数小于NA个;C正确;D错,标准状况下水不是气体;
本题难度:一般
5、选择题 溶液中只含K+、Fe2+、Cl-、SO42-四种离子.已知K+、Fe2+、Cl-的个数比为3:2:1,则溶液中Fe2+与SO42-的个数比为
A.2:3
B.1:4
C.1:1
D.3:2
参考答案:A
本题解析:设K+、Fe2+、Cl-的物质的量分别为3mol,2mol,1mol。根据电荷守恒可以计算出硫酸根离子为3mol。所以溶液中Fe2+与SO42-的个数比为2:3
点评:本题难度不高,抓住选择题的做题技巧,可以把计算过程简略。
本题难度:一般