1、选择题 用稀H2S04、NaOH溶液和Al为原料制取Al(OH)3,有下列三种不同的途径。
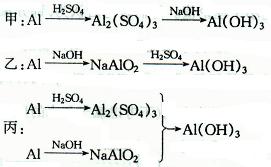
若制取等量的Al(OH)3,则?(?)
A.甲、乙消耗的源料同样多
B.丙消耗的原料最少
C.乙消耗的原料最少
D.三者消耗的原料同样多
参考答案:C
本题解析:略
本题难度:一般
2、填空题 目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
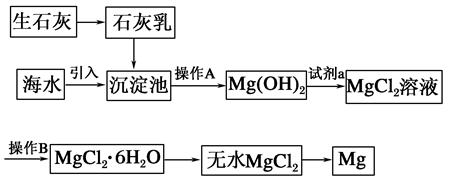
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是________,写出在沉淀池中发生反应的离子方程式:_________________________________________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量试剂a是________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为________,从考虑成本和废物循环利用的角度,副产物氯气可以用于________。
参考答案:(1)沉淀Mg2+[或使Mg2+形成Mg(OH)2沉淀]
Mg2++2OH-=Mg(OH)2↓
(2)贝壳(或牡蛎壳等)
(3)过滤 加热浓缩(或蒸发结晶) (4)HCl
(5)MgCl2(熔融)  Mg+Cl2↑ 制盐酸,循环使用
Mg+Cl2↑ 制盐酸,循环使用
本题解析:(1)石灰乳中的Ca(OH)2与海水中的镁盐发生复分解反应生成Mg(OH)2沉淀。
(2)海滩上贝壳的主要成分是CaCO3,可用于制取生石灰。
(3)从沉淀池中得到Mg(OH)2固体,应利用过滤操作,加热浓缩MgCl2溶液,可使其结晶出MgCl2晶体。
(4)溶解Mg(OH)2应用足量盐酸。
(5)MgCl2(熔融)  Mg+Cl2↑,Cl2可用于生产盐酸,循环利用。
Mg+Cl2↑,Cl2可用于生产盐酸,循环利用。
本题难度:一般
3、填空题 100 mLamoI/L的AlCl3溶液与100 mL b mol/L 的NaOH溶液混合,讨论a与b在不同关系时所得沉淀的物质的量。
当___时,____;
当___时,____;
当___时,____。
参考答案:当b≤3a时,n[Al(OH)3] =0.1b/3 mol;
当3a<b<4a时,n[Al(OH)3]=(0.4a-0.1b)mol;
当 b≥4a时,n[Al(OH)3]=0。
本题解析:
本题难度:一般
4、选择题 已知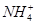 + [AI(OH)4]—?===
+ [AI(OH)4]—?===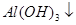
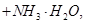 向含有等物质的量的
向含有等物质的量的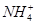 、
、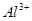 、
、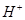 的混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应:
的混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应:
①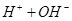 ===
=== ?②
?②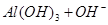 ===[AI(OH)4]—③
===[AI(OH)4]—③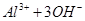 ===
===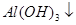 ?
?
④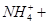 ?
?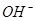 ===
=== ?发生反应的先后顺序正确的是
?发生反应的先后顺序正确的是
A.①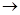 ④
④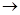 ③
③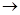 ②
②
B.①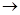 ③
③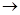 ②
②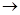 ④
④
C.① ③
③ ④
④ ②
②
D.① ②
② ③
③ ④
④
参考答案:C
本题解析:根据已知反应可知,三种离子结合OH-的顺序是H+、Al3+、NH4+。又因为氢氧化铝是两性氢氧化物,能溶于强碱中,所以的正确的答案选C。
本题难度:一般
5、填空题 如图所示,把试管小心地放入盛有(20 ℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5mL稀盐酸于试管中。试回答下列问题

(1)实验中观察到的现象是
①镁片上有大量气泡产生;②镁片逐渐溶解;③_______________________。
(2)产生上述现象的原因是_______________________
(3)由实验推知,MgCl2溶液和氢气的总能量______________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)③烧杯中液体放出气泡的速率加快
(2)镁与稀盐酸反应产生H2,该反应为放热反应,碳酸饮料中CO2气体在水中的溶解度随温度升高而减小,故烧杯中液体放出气泡的速率逐渐加快
(3)小于
本题解析:
本题难度:一般