1、选择题 下列哪一个分子模型属于球棍模型?(?)
A.苯分子
B.水分子
C.乙炔分子
D.乙烯分子
参考答案:C
本题解析:略
本题难度:简单
2、简答题 推断:
现有A、B、X、Y、Z五种短周期元素,原子序数依次增大,它们的性质或原子结构如下表:
| 元素 | 性质或原子结构
A
原子核内只有一个质子
B
单质是空气中含量最多的气体
X
原子的最外层电子数是次外层电子数的3倍
Y
短周期元素中原子半径最大的元素
Z
最高正化合价与最低负化合价的代数和为6
|
回答:(1)X元素在元素周期表的位置是______、______
(2)Z单质通入Y的最高价氧化物对应水化物的溶液中,可以得到漂白液,该反应的离子方程式为______.
(3)化合物甲由A和B两种元素组成且质量比为3:14.甲与X单质在催化剂加热条件下发生的反应是工业上制取硝酸的基础,写出该反应的化学方程式______.
参考答案:A原子核内只有一个质子,应为H元素,B单质是空气中含量最多的气体,应为N元素,X原子的最外层电子数是次外层电子数的3倍,则原子核外各层电子数分别为2、6,应为O元素,Y为短周期元素中原子半径最大的元素,应为第三周期ⅠA族元素,即Na元素,Z最高正化合价与最低负化合价的代数和为6,则最高化合价为+7价,应为Cl元素,
(1)X为O元素,原子核外有2个电子层,最外层电子数为6,则应位于周期表第二周期、VIA族,
故答案为:第二周期;VIA族;
(2)Z单质为Cl2,Y的最高价氧化物对应水化物为NaOH,Cl2在NaOH溶液中发生氧化还原反应,反应的离子方程式为
Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)化合物甲由A和B两种元素组成且质量比为3:14,应为NH3,NH3与O2在催化剂条件下反应生成NO,反应的化学方程式为4NH3+5O2?催化剂?.高温高压4NO+6H2O,
故答案为:4NH3+5O2?催化剂?.高温高压4NO+6H2O.
本题解析:
本题难度:一般
3、简答题 在下列各组气体中,试分析判断哪种气体更易液化?
①Cl2、N2;②SiH4、CH4;③SO2、CO2;④邻二甲苯、对二甲苯;⑤甲烷、乙烷;⑥丁烷、异丁烷
参考答案:①Cl2 ②SiH4 ③SO2 ④邻二甲苯 ⑤乙烷 ⑥丁烷
本题解析:①②⑤三组气体中的分子均为组成结构相似的分子,只要从相对分子质量的大小就可以判断更易液化的气体分别是各组气体中相对分子质量较大的分子,即①Cl2、②SiH4、⑤乙烷。③组中SO2的相对分子质量大于CO2的相对分子质量,并且SO2是极性分子,所以SO2分子间的范德华力大于CO2分子间的范德华力,故SO2易液化。④组中的邻二甲苯、对二甲苯的相对分子质量相等,邻二甲苯是极性分子,对二甲苯是非极性分子,所以邻二甲苯分子间的范德华力大于对二甲苯分子间的范德华力,故邻二甲苯易液化。⑥组中丁烷、异丁烷是同分异构体,异丁烷分子含有支链,使分子间接触面积减小,分子间作用力减小,所以丁烷分子更易液化。
本题难度:一般
4、填空题 (1)现有下列物质①KI ②NH4Cl ③Na2O2 ④O2 ⑤H2S ⑥N2 ⑦CaF2 ⑧PCl3 ⑨NaOH其中只含有离子键的是_________ ,只含有极性共价键的是__________ ,既含有离子键又含有非极性键的是__________ 。(均填数字代号)
(2)写出下列物质的电子式:Na2O2_____________ ,CCl4______________ , CO2________________。
(3)用电子式表示下列物质的形成过程: MgCl2 _______________, H2O2 __________________。
参考答案:(1)①⑦? ;⑤⑧? ;③
(2)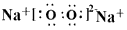 ?;
?; 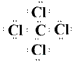 ?;
?;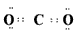
(3) ?;
?;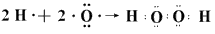
本题解析:
本题难度:一般
5、选择题 2009年11月26日,中国正式对外宣布控制温室气体排放的行动目标,决定到2020年单位国内生产总值二氧化碳排放比2005年下降40%~45%。下列说法正确的是
A.控制二氧化碳的排放是有效防止酸雨的重要措施
B.二氧化碳是一种含有非极性共价键的非极性分子
C.二氧化碳分子的比例模型为
D.广泛使用高效节能的荧光电灯可以减少二氧化碳的排放量
参考答案:D
本题解析:二氧化碳是温室气体,减少它排放可减缓温室效应;它是由极性键组成的直线型、非极性分子:O=C=O,由于氧原子的半径小于碳原子,所以排除C;
广泛使用高效节能的荧光电灯可减少电能的消耗,一定会减少煤碳能源的消耗,必然也会减少二氧化碳的排放
故答案为D
本题难度:一般