1、选择题 下列常见金属的冶炼原理中不合理的是(?)
?
参考答案:C
本题解析:C选项中应为点解熔融状态的氧化铝
2Al2O3(熔融) 4Al+3O2 ↑
4Al+3O2 ↑
本题难度:一般
2、选择题 下列物质属于硅酸盐材料的是
[? ]
A.碳纤维
B.石灰石
C.普通水泥
D.石英玻璃
参考答案:C
本题解析:
本题难度:简单
3、选择题 要使3.2 g氧化铁完全还原,事先应准备的CO在标准状况下的体积为( )。
A.1 344 mL
B.672 mL
C.大于1 344 mL
D.小于672 mL
参考答案:C
本题解析:根据Fe2O3+3CO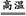 2Fe+3CO2计算出所需CO体积的理论值为1 344 mL,而实验开始时,需先通入CO排尽玻璃管中的空气,实验结束时,停止加热后,还需继续通入CO至试管冷却,以防还原出来的铁被氧化,另外,还应考虑到通入的CO不可能全部参加反应,故应大于1 344 mL。
2Fe+3CO2计算出所需CO体积的理论值为1 344 mL,而实验开始时,需先通入CO排尽玻璃管中的空气,实验结束时,停止加热后,还需继续通入CO至试管冷却,以防还原出来的铁被氧化,另外,还应考虑到通入的CO不可能全部参加反应,故应大于1 344 mL。
本题难度:一般
4、选择题 阅读下列材料,回答有关问题。
锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡离子有强还原性,+4价铅元素的化合物有强氧化性。例如:Sn2+还原性比Fe2+还原性强。PbO2的氧化性比Cl2氧化性强。
(1)写出下列反应的化学方程式:
①氯气跟锡共热:_____________________________________________________________;
②氯气跟铅共热:_____________________________________________________________;
③二氧化铅跟浓盐酸共热:_____________________________________________________。
(2)能说明Sn2+还原性比Fe2+还原性强的离子方程式是___________________________。
参考答案:
(1)①2Cl2+Sn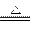 SnCl4? ②Pb+Cl2
SnCl4? ②Pb+Cl2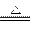 PbCl2? ③PbO2+4HCl
PbCl2? ③PbO2+4HCl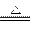 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
(2)Sn2++2Fe3+=Sn4++2Fe2+
本题解析:从已知信息可知,锡和铅的+4价比+2价稳定,所以它在化学反应中倾向于得到电子被还原表现强氧化性;+2价的锡和铅被强氧化剂氧化为+4价,而弱氧化剂则只能将它们氧化为+2价。
本题难度:简单
5、填空题 锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:

(1)酸浸时,二氧化锰被双氧水还原的化学方程式为_______。
(2)活性铁粉除汞时,铁粉的作用是______ (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液进行吸收而实现的。如下图是KMnO4溶液处于不同pH时对应的Hg去除率变化图,图中物质为Hg与 MnO4-在该pH范围内的主要产物。
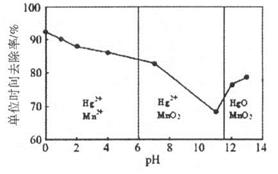
①请根据该图给出pH对汞去除率影响的变化规律:______。
②试猜想在强酸性环境下汞的单位时间去除率高的原因:______。
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成____________。
(5)经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是______。
参考答案:(15分)(1)MnO2 + H2O2 + H2SO4=MnSO4 +O2↑ + 2H2O(3分)(2)还原剂(2分)
(3)①随pH的升高汞的去除率先降低后增加(2分)
②Mn2+具有催化作用,单位时间内去除率高(2分)
(4)MnO·4ZnO·5Fe2O3(3分)
(5)调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成(3分)
本题解析:(1)二氧化锰被双氧水还原,说明二氧化锰是氧化剂,得到电子。双氧水是还原剂失去电子,其氧化产物是氧气,所以反应的化学方程式为MnO2 + H2O2 + H2SO4=MnSO4 +O2↑ + 2H2O。
(2)铁是活泼的金属,所以活性铁粉除汞时,铁粉的作用是还原剂。
(3)①根据图像可知,随着pH的升高汞的去除率先降低后增加。
②根据图像可知,在强酸性条件下,MnO4-的还原产物是Mn2+,Mn2+具有催化作用,所以单位时间内去除率高。
(4)当x=0.2时,该物质的化学式可表示为Mn0.2Zn0.8Fe2O4,即Mn、Zn、Fe的原子个数之比=1:4:10,所以用氧化物形式可表示为MnO·4ZnO·5Fe2O3。
(5)根据锰锌铁氧化体组成可知,加入一定量的MnSO4和铁粉可以调节滤液离子的成分,使其符合水热后获得锰锌铁氧化体组成
本题难度:一般