1、实验题 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
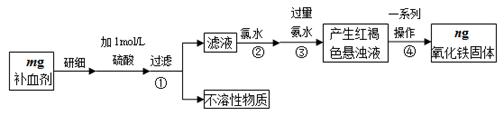
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要?。
(2)步骤②加入过量氯水后发生反应的离子方程式为?。
(3)步骤④中一系列操作步骤为???、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为?。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加? _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有?性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是?。
A.KSCN溶液
B.酸性KMnO4溶液
C.铁粉
D.FeCl3溶液
2、计算题 (6分)氢气还原氧化铜的反应不完全时,便得到Cu、Cu2O、CuO的固体混合物。化学兴趣小组同学为探究上述固体的成分进行了如下操作和实验:
(1)取一定质量的均匀固体混合物A,将其分成两等份。
(2)取其中—份用足量的氢气还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。
请回答以下问题:
(1)A中,n(CuO)+n(Cu2O)=?。
(2)A中,n(CuO)的取值范围是?。
(3)试计算所用稀硝酸的物质的量浓度_______________。
3、选择题 下列各组物质反应后,再滴入KSCN溶液,显红色的是
A.过量铁和稀盐酸
B.FeCl2溶液和氯水
C.过量铁和CuCl2溶液
D.过量铁和FeCl3溶液
4、选择题 某地污水中含有Zn2+、Hg2+、Fe3+、Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
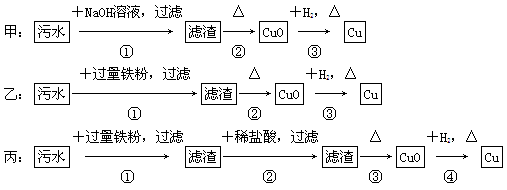
下列判断正确的是( )。
A.三种实验方案都能制得纯净的铜
B.乙方案中加过量铁粉可以将四种阳离子全部还原
C.甲方案中的反应涉及置换、分解、化合、复分解四种反应类型
D.丙方案会产生环境污染
5、选择题 下列物质中不能通过置换反应生成的是
[? ]
A.F2
B.CO
C.Fe3O4
D.S