1、选择题 在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入铁粉,经反应未见气体放出,析出3.2 g铜时,溶解的铁粉的质量是(?)
A.5.6 g
B.2.8 g
C.14 g
D.8.4 g
参考答案:D
本题解析:因氧化性Ag+>Fe3+>Cu2+,有3.2 g Cu析出,则Ag+、Fe3+被完全还原。
2Ag+? +? Fe====Fe2++2Ag
0.1 mol 0.05 mol
2Fe3+? +? Fe====3Fe2+
0.1 mol 0.05 mol
Cu2++Fe====Fe2++Cu
0.05 mol? 0.05 mol
故溶解的Fe粉的质量为m(Fe)="0.05" mol×3×56 g·mol-1="8.4" g。
本题难度:简单
2、选择题 FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A 加入KSCN溶液变红色? B 溶液中一定含Fe2+
C 溶液中一定含Cu2+? D剩余固体中一定含Cu
参考答案:AC
本题解析:分阶段分析
①、当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的反应方程式为:2FeCl3+Fe=3FeCl2
CuCl2+Fe=Cu+FeCl2
所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+;
②当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,
所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;
A、溶液中一定不含Fe3+,所以加入KSCN溶液不变红色,故A错误.
B、通过以上分析知,溶液中一定含有Fe2+,故B正确.
C、通过以上分析知,溶液中可能含有Cu2+,故C错误.
D、通过以上分析知,剩余固体中一定含Cu,故D正确.
故选A、C.
本题难度:简单
3、选择题 将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜。再经充分反应后,溶液中一定含有的金属离子是(? )
A.Fe3+和Cu2+
B.Fe2+和Cu2+
C.Fe2+
D.Fe2+和Fe3+
参考答案:C
本题解析:铜片和铁片表面的CuO和Fe2O3,加入足量的稀盐酸,先发生如下两个反应:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O。因为Fe比Cu活泼,Fe3+的氧化性比Cu2+的强,所以再发生反应:2Fe3++Fe=3Fe2+,若Fe3+过量,则接着发生反应2Fe3++Cu=2Fe2++Cu2+,若Fe过量,则还会发生反应Fe+Cu2+=Fe2++Cu,但不论哪种情况溶液中都有Fe2+存在
本题难度:一般
4、选择题 将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L,则生成的NO和NO2的体积之比为(?)
A.1:2
B.2:1
C.1:1
D.4:1
参考答案:C
本题解析:设生成的NO和NO2的物质的量是x和y。混合气的物质的量是0.5mol,则x+y=0.5mol。铜的物质的量是0.5mol,失去0.5mol×2=1mol电子。则根据电子得失守恒可知,3x+y=1mol,解得x=y=0.25mol,所以生成的NO和NO2的体积之比为1:1,答案选C。
点评:该题是中等难度的试题,试题贴近高考,基础性强,侧重能力的培养和解题方法与技巧的训练,有助于培养学生的创新思维能力,提高学生分析问题、解决问题的能力。该题的关键是利用好计算题中的守恒法,即质量守恒定律、电子得失守恒、原子守恒等,需要学生在平时的学习中积累、总结,并能灵活运用。
本题难度:简单
5、填空题 分某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:
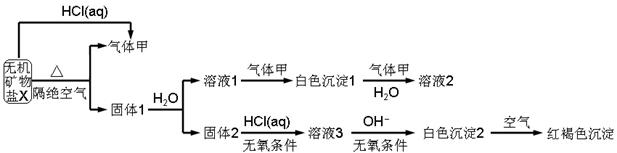
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
参考答案:(1) ?
?
(2)CaFeC2O6(或CaCO3·FeCO3);CaCO3·FeCO3△CaO+FeO+2CO2↑。
(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4)3FeO+CO2===Fe3O4+CO检验方法:Fe2O3:将固体加入盐酸溶解,再滴入KSCN溶液,溶液呈血红色;CuO:将固体加入盐酸溶解,再滴入氨水溶液,溶液出现蓝色沉淀,继续加入氨水,沉淀溶解,生成深蓝色溶液。
本题解析:白色沉淀2在空气中变成红褐色沉淀说明白色沉淀2是Fe(OH)2。溶液1中通入甲气体,有白色沉淀1,再通入甲气体(注意:水存在时)又溶解,甲气体是弱酸性气体,根据X与固体1的质量确定是CO2。
本题难度:一般