1、选择题 下列混合溶液中,各离子浓度的大小顺序不正确的是(?)
A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=2c(Na+)
B.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是: c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+)
C.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D.CH3COONa溶液中c(OH-) = c(CH3COOH) +c(H+)
参考答案:C
本题解析:0.1 mol/L Na2CO3溶液中,电荷守恒c(H+)+c(Na+)=c(OH-)+ c(HCO3-)+2c(CO32-),物料守恒c(Na+)=2[c(CO32-)+c(HCO3-)+ c(H2CO3)],可得c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),C项错误,其他选项均正确。
点评:本题主要考查的是三大守恒定律的应用,难度较大。
本题难度:一般
2、选择题 由几种常见的盐混合组成的白色粉末,其中只可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、NO2-中的若干种离子。某同学对该溶液进行如下实验:
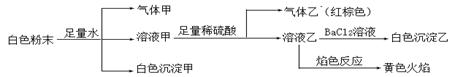
以下说法正确的是
A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3-
B.气体乙一定是NO和NO2的混合气体
C.白色沉淀乙是BaSO4,所以原混合物一定含有SO42-
D.白色粉末中一定含有Na+ 、Al3+ 、NO2-
参考答案:D
本题解析:因为在白色粉末中加入足量的水,会产生气体、白色沉淀,说明含有能够双水解的微粒。因此一定含有Al3+,与它双水解的离子是HCO3-还是CO32-不能确定,气体甲是CO2,沉淀甲是Al(OH)3。由于在白色粉末中加入的物质中不含Na元素,而溶液乙的焰色反应为黄色,说明在原来的溶液中含有Na+;向溶液甲中加入足量的稀硫酸产生的气体是红棕色,说明原溶液中含有NO2-离子。由于加入了稀硫酸,因此无论原来的溶液中是否含有SO42-离子,溶液乙中一定含有SO42-,向该溶液中加入BaCl2溶液时会产生BaSO4沉淀。综上所述。该混合物一定含有的离子是Na+ 、Al3+ 、NO2-。选项为D。
本题难度:一般
3、选择题 下列有关物质浓度关系的描述,正确的是? ( )。
A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH-)=c(H+)
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(CO32—)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3)
参考答案:AD
本题解析:25 ℃时,NaB溶液中根据电荷守恒可得:c(Na+)+c(H+)=c(B-)+c(OH-),则c(Na+)-c(B-)=c(OH-)-c(H+),根据NaB溶液的pH=8,则pOH=6,故c(Na+)-c(B-)=c(OH-)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1=9.9×10-7mol·L-1,A正确;向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液,首先发生的反应是2NH4HSO4+2NaOH===(NH4)2SO4+Na2SO4+2H2O,此时c(SO42—)=c(NH4+),但因为(NH4)2SO4是强酸弱碱盐,溶液呈酸性,若欲使溶液呈中性,则少量(NH4)2SO4继续与NaOH反应生成NH3·H2O,所以离子浓度关系应为c(Na+)>c(SO42—)>c(NH4+)>c(OH-)=c(H+),B错误;0.1 mol·L-1的NaHCO3溶液中,电荷守恒式为c(OH-)+2c(CO32—)+c(HCO3—)=c(H+)+c(Na+),物料守恒式为c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3),所以c(OH-)+c(CO32—)=c(H+)+c(H2CO3),C错误;因为酸性:CH3COOH>H2CO3>C6H5OH>HCO3—,则它们对应盐的水解程度c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3),所以同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3),D正确。
本题难度:一般
4、填空题 已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________(填“增大”、“减小”或“不变”)
参考答案:(1)1×10-14 (2)H2SO4 (3)NH4Cl (4)1×10-9 mol/L 1×10-5 mol/L (5)> 减小
本题解析:(1)在室温时,水的离子积常数为1×10-14。
(2)加水稀释后H2SO4溶液中H+直接稀释,而NH4Cl溶液中NH4++H2O NH3·H2O+H+平衡右移,溶液中H+被稀释同时,又增加,故pH较大的是H2SO4溶液。
NH3·H2O+H+平衡右移,溶液中H+被稀释同时,又增加,故pH较大的是H2SO4溶液。
(3)升高温度促进NH4+的水解,H+浓度增大,故pH较小的是NH4Cl溶液。
(4)由水电离的c(H+)等于由水电离出的c(OH-),故H2SO4溶液中由水电离出的c(H+)= =10-9 mol/L,NH4Cl溶液中水电离出的c(H+)=1×10-5 mol/L。
=10-9 mol/L,NH4Cl溶液中水电离出的c(H+)=1×10-5 mol/L。
(5)加水稀释后使平衡NH4++H2O NH3·H2O+H+右移,故c(H+)>10-6 mol/L,
NH3·H2O+H+右移,故c(H+)>10-6 mol/L, 减小。
减小。
本题难度:一般
5、选择题 某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-),该溶液可能是()
A.由0.1mol·L-1的CH3COOH溶液与0.1mol·L-1的NaOH溶液等体积混合而成
B.由10mLpH=3的CH3COOH溶液与1mLpH=11的NaOH溶液混合而成
C.由0.1mol·L-1的CH3COONa溶液与0.1mol·L-1的NaOH溶液等体积混合而成
D.由0.1mol·L-1的CH3COONa溶液与0.1mol·L-1的CH3COOH溶液等体积混合而成
参考答案:D
本题解析:由题干信息:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),判断溶液显酸性。
A项中混合后生成CH3COONa溶液,显碱性,不选。B项中CH3COOH电离产生的n(H+)=10mL×10-3mol·L-1,大于NaOH电离产生的n(OH-)=1mL×10-3mol·L-1;溶液生成CH3COONa水解显碱性,n(CH3COONa)=1mL×10-3mol·L-1,而剩余n(H+)更多,故B项应为c(CH3COO-)>c(H+)>c(Na+)>c(OH-),不选。C项溶液混合后显碱性,故不选。D项在等物质的量浓度时,弱酸(或弱碱)的电离往往占优势,故选D。
本题难度:简单