1、选择题 已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O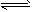 CH3COO-+H3O+? K1=1.75×10-5
CH3COO-+H3O+? K1=1.75×10-5
CH3COO-+H2O CH3COOH+OH-? K2 =5.71×10-10
CH3COOH+OH-? K2 =5.71×10-10
现将50 mL 0.2 mol/L醋酸与50 mL 0.2 mol/L醋酸钠溶液混合制得溶液甲,下列叙述正确的是
[? ]
A.溶液甲的pH >7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的NaOH溶液,溶液的pH明显增大
D.若在溶液甲中加入5 mL 0.1 mol/L的盐酸,则溶液中醋酸的K1会变大
参考答案:B
本题解析:
本题难度:一般
2、选择题 在允许加热的条件下,只用一种试剂就可鉴别NH4Cl、(NH4)2SO4、NaCl、Al2(SO4)3和Fe2(SO4)3溶液,该试剂可能是
A.Ba(OH)2溶液
B.AgNO3溶液
C.NaOH溶液
D.BaCl2溶液
参考答案:A
本题解析:取样,分别加入Ba(OH)2溶液,加热,只有刺激性气味的气体生成的是NH4Cl;既有刺激性气体,又有白色沉淀生成的是(NH4)2SO4;没现象的是NaCl;只有白色沉淀,但沉淀又部分溶解的是Al2(SO4)3;有白色沉淀和红褐色沉淀生成的是Fe2(SO4)3;故此试剂是Ba(OH)2溶液。
本题难度:一般
3、选择题 常温下,稀释0.1 mol·L-1Na2CO3溶液,下图中的纵坐标可以表示?(?)
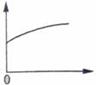
A.CO32—水解的平衡常数
B.溶液的pH
C.溶液中HCO3—离子数
D.溶液中c(CO32—)
参考答案:C
本题解析:A项:CO32—水解的平衡常数只与温度有关,故错;B项:稀释会使PH变小,故错;D项:稀释会使c(CO32—)变小,故错。
故选C。
点评:本题考查的是水解的平衡常数和盐类水解的影响因素,考查学生对基础知识的掌握程度,题目难度适中。
本题难度:一般
4、选择题 在V mL 0.1 mol/L Na2S溶液中逐滴加入V mL 0. 1 mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是
A.c(SO42-)= c(HS-) =c(K+) >c(OH-)=c(H+)
B.c(Na+)> c(K+)> c(S2-)> c(H+)>c(OH-)
C.c(Na+)= c(S2-)+ c(H2S)+c(HS-)+ c(SO42-)
D.c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
参考答案:C
本题解析:A.等量的Na2S 与KHSO4反应生成NaHS、Na2SO4?K2SO4。Na2SO4 和K2SO4溶液显中性,NaHS溶液显碱性。故反应后溶液显碱性,c(H+)<c(OH-),错误;B.分析见A选项; C选项,0.1 mol/L Na2S溶液中,由物料守恒:c(HS-)+c(S2-)+c(H2S) =0.1 mol/L c(Na+)=0.2 mol/L,0. 1 mol/L KHSO4溶液中,c(SO42-)=0.1 mol/L 。所以c(Na+)= c(HS-)+c(S2-)+c(H2S)+ c(SO42-) =0.1 mol/L +0.1 mol/L=0.2 mol/L,正确;D选项,考查电荷守恒,但是c(SO42-)与c(S2-)前面的系数应该为2,错误。
本题难度:一般
5、选择题 下列溶液中有关物质的量浓度关系不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH) < c(NaHCO3) <c(CH3COONa)
B.已知25℃时Ksp (AgCl)=1.8×10-10,则在0.3mol·L-1NaCl溶液中,Ag+的物质的量浓度最大可达到6. 0×10-10mol·L-1
C.25℃时,0.1mol·L-1Na2CO3溶液中水电离出来的c(OH-)大于0.1mol·L-1NaOH溶液中水电离出来的c(OH-)
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有c(HA-) >c(H+)>c(H2A)>c(A2-)
参考答案:D
本题解析:A中由于后两者都为强碱弱酸盐发生水解显碱性,所以浓度比氢氧化钠大,而又因为醋酸的酸性大于碳酸,所以碳酸氢钠的碱性强于醋酸钠,所以碳酸氢钠的浓度比醋酸钠的浓度低。B中根据一定温度下AgCl的溶度积Ksp(AgCl)=c(Ag+)?c(Cl-)计算,正确。C中碳酸钠中因为有水解,增强水的电离,而氢氧化钠抑制了水的电离,正确。D中由于显酸性,所以HA-以电离为主,c(H2A)浓度比A2-低。
点评:本题综合性较高,为常规题,需掌 握常见盐类的水解。难度不大。
本题难度:一般