1、填空题 (15分)海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,
最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式
Ksp=?。
(2)MgCl2溶液显酸性,其水解的离子方程式为?。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有?
a.MgO? b.Mg(OH)2? c.MgCO3? d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一
?。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是?。
(6)电解熔融的MgCl2,阳极的电极反应式为:?;阴极的电极反应式为?。
参考答案:(1)Ksp=c(Mg2+)·c2(OH-) (3分)
(2)Mg2+ + 2H2O  ?Mg(OH)2 +2H+(2分)
?Mg(OH)2 +2H+(2分)
(3)abc(2分)
(4)MgCl2·6H2O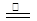 Mg(OH)Cl + HCl↑+5H2O↑或MgCl2·6H2O
Mg(OH)Cl + HCl↑+5H2O↑或MgCl2·6H2O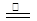 MgO + 2HCl↑+5H2O↑(2分)
MgO + 2HCl↑+5H2O↑(2分)
(5)HCl气流可抑制Mg2+水解(2分)
(6)2Cl――2e-=Cl2↑(2分);Mg2++2e-=Mg(2分)
本题解析:⑴根据Mg(OH)2的溶解平衡式:Mg(OH)2(s) Mg2+(aq)+2OH- (aq),写出其溶度积常数表达式;
Mg2+(aq)+2OH- (aq),写出其溶度积常数表达式;
⑵MgCl2溶液中Mg2+水解:Mg2+ + 2H2O  ?Mg(OH)2 +2H+,使溶液显酸性;
?Mg(OH)2 +2H+,使溶液显酸性;
⑶根据FeCl3的水解:FeCl3+3H2O Fe(OH)3+3HCl,加入MgO、Mg(OH)2、MgCO3均能促进FeCl3的水解,使其转化Fe(OH)3沉淀而除去,同时过量的MgO、Mg(OH)2、MgCO3可通过过滤除去。
Fe(OH)3+3HCl,加入MgO、Mg(OH)2、MgCO3均能促进FeCl3的水解,使其转化Fe(OH)3沉淀而除去,同时过量的MgO、Mg(OH)2、MgCO3可通过过滤除去。
⑷在空气中加热MgCl2·6H2O,促进MgCl2的水解,有HCl、H2O逸出,当生成Mg(OH)Cl时其反应方程式为MgCl2·6H2O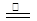 Mg(OH)Cl + HCl↑+5H2O↑;当生成MgO时其反应方程式为MgCl2·6H2O
Mg(OH)Cl + HCl↑+5H2O↑;当生成MgO时其反应方程式为MgCl2·6H2O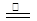 MgO + 2HCl↑+5H2O↑。
MgO + 2HCl↑+5H2O↑。
⑸MgCl2·6H2O在干燥的HCl气流中加热,HCl气流可抑制Mg2+水解,这样可得到无水氯化镁。
⑹电解熔融的MgCl2,阳极发生氧化反应,其电极反应式为2Cl――2e-=Cl2↑;阴极发生还原反应,其电极反应式为Mg2++2e-=Mg。
本题难度:一般
2、选择题 下列叙述中正确的是
A.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH )
B.将pH = 3的一元弱酸HA和pH = 11的NaOH溶液混合后溶液显碱性,一定有:
c(H+) < c(OH- )< c(A-) <c(Na+)
C.在常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,体积为20 mL,则溶液的pH = 12+lg2
D.将0.2 mol·L-1的盐酸与0.1 mol·L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-)
参考答案:A
本题解析:酸越弱,相应的钠盐越容易水解,酸性是醋酸>碳酸>苯酚>碳酸氢钠,所以碳酸钠的水解程度最大,碱性最强。由于氢氧化钠是强碱,因此在pH相同的条件下,氢氧化钠的浓度最小,所以选项A正确。B中HA如果是强酸,则氢氧化钠过量,溶液才能显碱性。但如果HA是弱酸,则要使溶液显碱性,则氢氧化钠也是过量的,所以c(OH- )就可以大于c(A-) 的,B不正确。
C中碱过量,所以反应后的溶液中c(OH- )=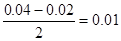 mol/L,所以pH=12,C不正确。
mol/L,所以pH=12,C不正确。
D中生成物是氢氧化铝、氯化铝和氯化钠,所以c(Al3+)>c(H+),D不正确。答案选A。
本题难度:一般
3、选择题 常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.0.1 mol·L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+)
参考答案:CD
本题解析:新制氯水中加入氢氧化钠后,反应所得溶液中有电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;碳酸氢钠溶液显碱性,说明水解大于电离,所以水解产生的c(H2CO3) 大于电离产生的c(CO32-),故B错误;NH4Cl与氨水的混合溶液呈中性,则c(OH-)=c(H+),因此必然有c(Cl-)=c(NH),C正确;CH3COONa溶液有质子守恒c(OH-)=c(CH3COOH)+c(H+),故D正确;故选CD。
本题难度:一般
4、选择题 100mL0.1mol/L的下列溶液中,阴离子总数多少的排列顺序正确的是
①CaCl2?②CH3COONa?③NaCl?④Na2CO3
A.①>④>③>②
B.①>④>③=②
C.①>④=③=②
D.①>④>②>③
参考答案:A
本题解析:①氯化钙阴离子的物质的量为:0.1L×0.1mol/L×2=0.02mol。②醋酸钠中阴离子的物质的量为:0.1L×0.1mol/L=0.01mol,又因为醋酸根水解,故小于0.01mol。③氯化钠中阴离子物质的量为:0.1L×0.1mol/L=0.01mol。④碳酸钠中阴离子的物质的量为:0.1L×0.1mol/L=0.01mol,由于碳酸根水解,CO32-+H2O HCO3-+OH-故大于0.01mol。故①>④>③>②。
HCO3-+OH-故大于0.01mol。故①>④>③>②。
本题难度:一般
5、选择题 30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是( )。
A.c(H+)·c(OH-)<1×10-14
B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
参考答案:D
本题解析:A 错误,30℃大于25℃,所以,c(H+)·c(OH-)>1×10-14
B 错误,Na2S中,c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
NaHS中,c(Na+)=c(S2-)+c(HS-)+c(H2S)
C 错误,只有Na2S溶液中存在
D 正确,两种溶液中都存在电荷守恒
故选D
本题难度:一般