1、选择题 将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+) > c (X- ),则下列关系正确的是:
A.c (OH- ) < c (H+ )
B.c (HX ) < c (X- )
C.c (X- ) + c(HX )=" 2c" (Na+)
D.c (Na+ ) + c (HX) ="=" c( H+ ) +c (OH-)
参考答案:C
本题解析:由电荷守恒知c (Na+ ) +c( H+ )=c (X-) + c (OH-),若c(Na+) > c (X-),则c (OH-)> c (H+ ) ,A不正确。溶液显碱性,说明盐的水解程度大于酸的电离程度,因此c (HX )> c (X-) ,B不正确。由物料守恒可知c (X-) + c(HX )=2 c (Na+),选项C正确,将c (X-) + c(HX )=2c (Na+) 和c (Na+ ) +c( H+ )=c (X-) + c (OH-)合并得到c (Na+ ) + c (OH-)=c( H+ ) + c (HX) ,D不正确,答案选C。
本题难度:简单
2、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是(?)
A.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
参考答案:D
本题解析:A.在1.0mol/L Na2CO3溶液,根据电荷守恒可得:c(OH-)+c(HCO3-)+2c(CO32-)=c(H+)+c(Na+),根据物料守恒可得:c(Na+)="2" c(HCO3-)+2c(CO32-)+2 c(H2CO3),将第二个式子代入第一个式子可得, c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),错误。B.1.0mol/LNH4Cl溶液,根据物料守恒可得:c(NH3·H2O)+c(NH4+)=c(Cl-),所以c(NH4+)<c(Cl-),错误;C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,根据电荷守恒可得:(CH3COO-)>c(Na+)>cc(H+)>c(OH-) ,错误;D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液,由于c(H+)=c(Cl-),根据电荷守恒c(Na+)+ c(H+)=c(Cl-)+c(NO3-),所以c(Na+)=c(NO3-),正确。
本题难度:一般
3、选择题 关于NaHCO3溶液的表述正确的是(?)
A.c( Na+) = c( HCO3-) + c( CO32-) + c( H2CO3 )
B.c( Na+ ) + c( H+) = c( HCO3-) + c( CO32-) +c( OH- )
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离平衡有: HCO3—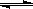 H++CO3
H++CO3 2—,H2O
2—,H2O 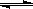 H++OH—
H++OH—
参考答案:AD
本题解析:略
本题难度:一般
4、填空题 (1)0.02 mol·L-1的HCN溶液与0.02 mol·L-1 NaCN溶液等体积混合,已知该混合溶液中c (Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -)?c(H +)?② c(HCN)?c(CN-)
(2)常温下,向明矾溶液中滴入Ba(OH)2溶液至SO42- 刚好完全沉淀时,溶液
pH?7,(用“>、<、=”符号填空)反应的离子方程式为__________________________________。
(3)BaCO3分别加入:① 30mL水?②10mL 0.2mol/LNa2CO3溶液?③50mL 0.01mol/L
氯化钡溶液?④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中
Ba2+的浓度由大到小的顺序为:___________________________________________。
参考答案:(1)①? > (2分),?② > (2分);
(2)> (2分),? Al3++2SO42-+2Ba2++4OH- = 2BaSO4↓+ AlO2-?(2分);
(3)?③④①②?(2分)
本题解析:(1)根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(CN-),所以当c (Na+)> c(CN-)时,c(OH -)>c(H +),这说明溶液显碱性,所以HCN的电离程度小于NaCN的水解程度,因此c(HCN)>c(CN-)。
(2)明矾是KAl(SO4)2,当SO42- 刚好完全沉淀时,需要2molBa(OH)2溶液,则此时铝离子恰好生成KAlO2,KAlO2水解显碱性,反应式为Al3++2SO42-+2Ba2++4OH- = 2BaSO4↓+ AlO2-。
(3)BaCO3(s) Ba2+(aq)+CO32-(aq)碳酸钡的在溶液中存在溶解平衡,根据溶度积常数可知CO32-浓度越大,钡离子浓度就越小、平衡向右,可以增大钡离子的浓度,所以正确的顺序是③④①②
Ba2+(aq)+CO32-(aq)碳酸钡的在溶液中存在溶解平衡,根据溶度积常数可知CO32-浓度越大,钡离子浓度就越小、平衡向右,可以增大钡离子的浓度,所以正确的顺序是③④①②
本题难度:一般
5、选择题 下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-]
B.0.1 mol·L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S]
C.0.1 mol·L-1 NaHCO3溶液中:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-]
参考答案:C
本题解析:A、硫酸氢钠溶于水完全电离出H+、Na+、SO42-,所以0.1 mol·L-1 NaHSO4溶液中离子浓度大小关系是[H+]>[Na+]=[SO42-]>[OH-],A不正确;B、根据物料守恒可知 0.1 mol·L-1Na2S溶液中:[Na+]=2[S2-]+2[HS-]+2[H2S],B不正确;C、根据电荷守恒可知0.1 mol·L-1 NaHCO3溶液中:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-],C正确;D、乙酸是弱酸,则 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后恰好反应生成的乙酸钠水解,溶液显碱性,则溶液中离子浓度大小关系是[Na+]>[CH3COO-]>[OH-]>[H+],D不正确,答案选C。
本题难度:一般