1、简答题 已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,A为硫酸盐反应②为D的溶液与C在加热条件下的反应,P溶液和G溶液中具有相同的阳离子,请根据要求回答下列问题.
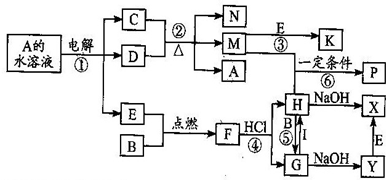
(1)B元素在周期表的位置:______,
(2)物质I的电子式:______.
(3)Y转变为X的现象是:______.涉及的反应方程式为:______.
(4)写出反应④的化学反应方程式:______.物质F与HI水溶液的离子反应方程式?式:______.
(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质______.
A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa2O2,所发生的离子反应方程式:______.
参考答案:A为硫酸盐,电解硫酸盐溶液,阳极上生成氧气E,阴极上析出金属单质C,说明金属单质C的活动性小于氢元素,且C为常见的金属单质,所以C是铜,则D是硫酸,A是硫酸铜;加热条件下,浓硫酸和铜反应生成硫酸铜、二氧化硫和水,水和硫酸铜都不与氧气反应,二氧化硫和氧气反应生成三氧化硫,所以M是二氧化硫,N是水,K是三氧化硫;B是金属,H和B反应生成G,G和I反应生成H,说明B是变价金属,且是常见金属,所以B是铁,铁和氧气反应生成四氧化三铁F,四氧化三铁和盐酸反应生成氯化铁和氯化亚铁,H和铁反应生成G,所以H是氯化铁,G是氯化亚铁,氯化亚铁和I反应生成氯化铁,则I是氯气,氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,氯化亚铁和氢氧化钠反应生成氯化钠和氢氧化亚铁,Y和氧气能生成X,所以X是氢氧化铁,Y是氢氧化亚铁,二氧化硫和氯化铁溶液反应生成硫酸根离子、亚铁离子.
(1)铁在周期表中位于第四周期第ⅤⅢ族,故答案为:第四周期第ⅤⅢ族;
(2)氯气的电子式为:
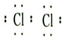
,故答案为:
;
(3)氢氧化亚铁是白色沉淀,但不稳定,迅速变成灰绿色,最终变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色絮状沉淀迅速变为灰绿色,最终转化为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,反应方程式为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,四氧化三铁和氢碘酸反应生成亚铁离子、碘单质和水,
离子方程式为Fe3O4+2I-+8H+=I2+3Fe2++4H2O,故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;Fe3O4+2I-+8H+=I2+3Fe2++4H2O;
(5)向沸水中加入H的饱和溶液,可制得氢氧化铁胶体,胶体的性质有:丁达尔效应、电泳、产生聚沉现象、不能透过半透膜,
A.氢氧化铁胶体具有丁达尔效应,故正确;
B.氢氧化铁胶粒带正电,加直流电源后,阴极附近溶液颜色加深,故错误;
C.加入盐酸溶液先出现聚沉现象,后盐酸和氢氧化铁反应生成氯化铁,所以出现的现象是先沉淀后溶解,故正确;
D.胶体粒子不能透过半透膜,能透过滤纸,故错误;
故选AC;
(5)向含1mol氯化亚铁溶液中加入1molNa2O2,根据得失电子数相等知,过氧化钠过量,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为Na2O2+H2O═2NaOH+12O2↑,氯化亚铁和氢氧化钠、氧气反应生成氢氧化铁和氯化钠,反应方程式为:2FeCl2+4NaOH+12O2+H2O═2Fe(OH)3↓+4NaCl,所以总的反应方程式为:4FeCl2+4Na2O2+6H2O═4Fe(OH)3↓+8NaCl+O2↑,离子方程式为:4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑,故答案为:4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑.
本题解析:
本题难度:一般
2、填空题 (8分)A、B、C、D、E、F、G、H、I、J、K都是中学课本常见物质,它们与X具有下图相互转化关系。
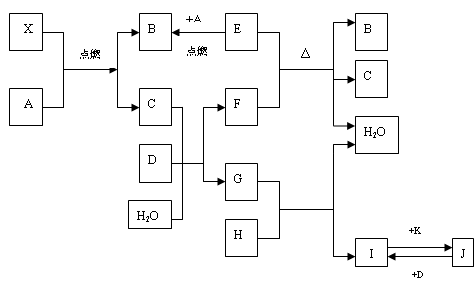
已知:①A、D、E、K为单质,其中E为黑色固体;
②X、A、B、C、D为气体,B、C均能使澄清石灰水变浑浊,C、D均能使品红溶液褪色;
③H是一种红棕色固体氧化物。
请回答下列问题:
(1)B分子的电子式:_______________;
(2)J与氨水反应的离子方程式:_______________________________________;
反应全过程的现象是:_____________________________________________;
(3)E和F反应的化学方程式:__________________________________________;
(4)气体X中含有三种元素,分子中各原子均达到8电子稳定结构,其对H2的相对密度为30,试推断X的分子式:___________;X的结构式:____________。
参考答案:(1)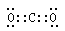
(2)Fe2++2NH3·H2O= Fe(OH)2↓+2NH4+
先生成白色沉淀,立即变为灰绿色,最终呈红褐色
(3)C+2H2SO4(浓)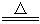 CO2↑+2 SO2↑+ 2H2O
CO2↑+2 SO2↑+ 2H2O
(4)SCO? S=C=O
本题解析:B、C均为气体且均能使澄清石灰水变浑浊,C能使品红溶液褪色,综合可判定B为CO2,C为SO2;而A为气体单质,与X气体燃烧可生成CO2与SO2,可知A为氧气,且X物质中含有最起码含有碳、硫元素;
C(SO2)、D均能使品红溶液褪色,且均为气体,猜测D为氯气(或臭氧等):Cl2+SO2+2H2O=H2SO4+2HCl;而黑色固体单质E可与A(氧气)燃烧生成CO2,则E为碳,碳与F可生成CO2、SO2及水,则可判定F为硫酸,而G为盐酸;
H是一种红棕色固体氧化物,也就是Fe2O3,与盐酸反应生成I,即FeCl3:Fe2O3+6HCl=2FeCl3+3H2O;J物质可与D(氯气)生成FeCl3,可知J为FeCl2,K为铁单质
(1)CO2为直线型分子,两个碳氧双键: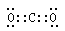
(2)制取 Fe(OH)2:Fe2++2NH3·H2O= Fe(OH)2↓+2NH4+
Fe(OH)2易被氧化,先生成白色沉淀,立即变为灰绿色,最终呈红褐色 Fe(OH)3
(3)C+2H2SO4(浓) CO2↑+2 SO2↑+ 2H2O
CO2↑+2 SO2↑+ 2H2O
(4)由题意知,分子中一定含有S和C原子,并且燃烧生成SO2与CO2,故第三种元素只能为O元素;相对分子质量为30×2=60,说明分子式只能为SCO;
分子中各原子均达到8电子稳定结构,则C形成四键,O、S均为二键,联系CO2的结构可得X的结构式为:S=C=O
本题难度:简单
3、填空题 Ⅰ.有关物质存在如图所示的转化关系(部分产物已省略)。通常B为黑色粉末,C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。

请回答下列问题:
(1)反应①的化学方程式为________________________________;
(2)反应②的离子方程式为________________________________ ;
(3)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。浓度为0.01mo1/L的D溶液与a mo1/L的Pb(NO3)2溶液等体积混合,则生成沉淀所需a的最小值为____________;
(4)电解F的溶液可以实现电能转化为化学能,请写出惰性电极电解足量的F溶液的离子方程式________________________________。
Ⅱ.辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是___________,当1mol O2发生反应时,还原剂所失电子的物质的量为______mol。向CuSO4溶液中加入镁条时有气体生成,该气体是____________。
参考答案:Ⅰ(1) MnO2 + 4HCl(浓) MnCl2 + H2O + Cl2↑?(2) 6I-+ClO3-+6H+=3I2+Cl-+3H2O
MnCl2 + H2O + Cl2↑?(2) 6I-+ClO3-+6H+=3I2+Cl-+3H2O
(3)5.6×10-4?(4) 2Cl-+ 2H2O  ?2OH- + H2↑ + Cl2↑
?2OH- + H2↑ + Cl2↑
Ⅱ.Cu2S;? 4;?氢气
本题解析:G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。
沉淀应为碘化铅PbO2,Ksp=碘离子浓度的平方乘以铅离子浓度,混合后碘离子浓度为0.005mo1/L,根据此式计算得Pb(NO3)2的物质的量浓度为5.6? × 10-4 mo1/L
(4)2Cl-+ 2H2O  ?2OH- + H2↑ + Cl2↑
?2OH- + H2↑ + Cl2↑
本题难度:一般
4、推断题 下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系
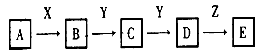
当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题:
(1)A是_______________,Y是______________,Z是_____________。
(2)当X是强碱时,E是_______________,当X是强酸,E是____________。
(3)写出A与X反应的离子方程式:
①______________________; ②_______________________。
参考答案:(1)A是(NH4)2S;Y是O2;Z是H2O
(2)E是HNO3;E是H2SO4
(3)NH4++OH-==NH3·H2O(或NH4++OH-==NH3↑+H2O);S2-+2H+=H2S↑
本题解析:
本题难度:一般
5、填空题 某些化学反应可用下式表示:A+B→C+D+H2O
请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应):
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为?(填化学式下同)。反应的化学方程式为?。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为?。反应的化学方程式为?。
(3)若A为紫红色金属,D为有色气体。则A为?。反应的离子方程式为?。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为?。反应的离子方程式为?。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为?。反应的化学方程式为?。
参考答案:(1)Cl2;2NaOH+Cl2=NaCl+NaClO+H2O
(2)C;C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (3)Cu;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
CO2↑+2SO2↑+2H2O (3)Cu;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
(4)CaCO3;2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-
(5)NH3;Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O↑(水的气体箭头不作要求)
CaCl2+2NH3↑+2H2O↑(水的气体箭头不作要求)
本题解析:(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为Cl2。B是氢氧化钠,则该反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,则气体应该是CO2和SO2,所以A为C,B是浓硫酸,该反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(3)若A为紫红色金属,则A是Cu;D为有色气体,则D可能是NO2,因此该是浓硝酸与铜发生的氧化还原反应,所以该反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,则C是碳酸钙,化学式为CaCO3。D为正盐,则D为碳酸盐,B就是碳酸氢钠盐,所以该反应的离子方程式为2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,说明C溶液显碱性。实验室常用此反应制备C气体,则C为NH3。因此该反应的化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
本题难度:一般