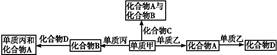
1、选择题 化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是(?)
A.甲、乙、丙三种单质均为气态非金属单质
B.上述转化关系所涉及的化合物中有一种是电解质
C.上图所示的五个转化关系中,有三个是化合反应
D.上图所示的五个转化关系中,均为氧化还原反应
参考答案:A
本题解析:根据甲(单质)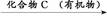 化合物A和B,据题意可推知甲为O2,C为烃,化合物A和B为CO2和H2O中的一种。再根据甲(O2)
化合物A和B,据题意可推知甲为O2,C为烃,化合物A和B为CO2和H2O中的一种。再根据甲(O2) 化合物A
化合物A 化合物D,可推知A为CO2,单质乙为C,D为CO,故化合物B为H2O,单质丙为H2。题中的单质C是固态非金属单质,故A错误;题中所涉及的化合物中H2O是电解质,其余是非电解质,B正确;题中的五个转化关系所涉及的反应方程式分别为CxHy+(x+
化合物D,可推知A为CO2,单质乙为C,D为CO,故化合物B为H2O,单质丙为H2。题中的单质C是固态非金属单质,故A错误;题中所涉及的化合物中H2O是电解质,其余是非电解质,B正确;题中的五个转化关系所涉及的反应方程式分别为CxHy+(x+ )O2
)O2 xCO2+
xCO2+ H2O,
H2O,
O2+C CO2,CO2+C
CO2,CO2+C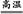 2CO,2H2+O2
2CO,2H2+O2 2H2O,H2O+CO
2H2O,H2O+CO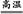 CO2+H2,故C、D正确。
CO2+H2,故C、D正确。
本题难度:一般
2、填空题 (15分)钛(Ti)被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减小环境污染。请填写下列空白:

(1)电解饱和食盐水时,该反应的离子方程式是____________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);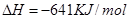
②

则 ____________
____________
反应:

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________
(3)写出钛铁矿与焦炭、Cl2共热制得四氯化钛的化学方程式______________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该燃料电池发生反应时正极区溶液的PH_____(填“增大”、“减小”或“不变”)该电池中负极上的电极反应是__________.
(5)在上述产业链中合成96t甲醇理论上消耗H2_________t(不考虑生产过程中物质的任何损失)
参考答案:(1)(2分)2Cl-+2H2O  Cl2↑+H2↑+2OH-?
Cl2↑+H2↑+2OH-?
(2)-512 KJ/mol (2分)
Mg和Ti都有较强还原性,在高温下都易与空气中的O2反应(2分)
(3)2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO(3分)
2FeCl3+2TiCl4+6CO(3分)
(4)增大(2分)? CH3OH-6e-+8OH-=CO32-+6H2O(2分)?(5)12?(2分)
本题解析::(1)电解食盐水生成NaOH、H2和Cl2,
利用盖斯定律2①-②即可计算出反应热为-512 KJ/mol。由于Mg和Ti都有较强还原性,在高温下都易与空气 中的O2反应,所以反应要在Ar气氛中进行。
(3在碱性环境中正极: O2 + 4e- + 2H2O= 4OH- ,所以正极附近的碱性增强。负极甲醇发生氧化反应,CH3OH-6e-+8OH-=CO32-+6H2O
(5)CO(g)+2H2(g)←→ CH3OH(g)
4?32
X? 96t
x="12" t
点评:本题以学生不熟悉的金属钛(Ti)为题眼,结合化学工艺,考查的知识面广,但是设计的知识点简单。注重对基础知识点的考查。
本题难度:一般
3、填空题 室温下,单质A、B、C分别为常见金属、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的.

请回答下列问题:
(1)A是______B是______(填化学式)
(2)反应①的化学方程式为______
(3)反应③的化学方程式为______
(4)反应④的化学方程式为______.
参考答案:B为黄绿色气体,应为Cl2,C是无色气体单质且能和氯气反应,则C是H2,E是HCl,盐酸能和A反应生成F和氢气,则A是氢之前的金属,F能被氯气氧化生成D,金属单质A能和氯气反应生成D,则A是变价金属且位于氢之前,则A是Fe,D是FeCl3,F是FeCl2,
(1)通过以上分析知,A是Fe,B是Cl2,
故答案为:Fe;Cl2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2点燃.2FeCl3,故答案为:2Fe+3Cl2点燃.2FeCl3;
在2Fe+3Cl22FeCl3
(3)反应③为铁和稀盐酸的反应,反应方程式为:2HCl+Fe=FeCl2+H2↑,故答案为:2HCl+Fe=FeCl2+H2↑;
(4)反应④为氯化亚铁和氯气的反应,反应方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
本题解析:
本题难度:一般
4、选择题 无色气体X和灼热的炭反应后得另一种无色气体Y,Y和灼热的氧化铜反应后又得无色气体X.则X、Y分别是
A.O2、CO
B.CO2、CO
C.CO、CO2
D.O2、CO2
参考答案:B
本题解析:
本题难度:一般
5、填空题 已知A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
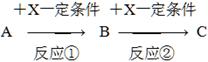
试回答:
(1)若X是强氧化性单质,则A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为________;C溶液在储存时应加入少量X,理由是(用必要的文字和离子方程式表示)___________________。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质溶液,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为________或________。
参考答案:(1)de?(2)FeCl3 Fe+2Fe3+===3Fe2+,防止Fe2+被氧化成Fe3+
(3)Al(OH)3 HCl NaOH? AlO2—+H++H2O===Al(OH)3↓?Al3++3OH-===Al(OH)3↓
本题解析:此转化关系与我们熟悉的连续氧化非常相似。
(1)当X是强氧化性单质(如:O2)时,S、N2、Na均可被连续氧化,而Mg、Al只能被氧化一次。因此A不可能是Mg、Al。
(2)由于C溶液中滴加AgNO3溶液生成不溶于稀硝酸的白色沉淀,所以C中含有Cl-,X应为变价金属,我们常见的有铁、铜等,经验证,X为Fe,A为Cl2。
Cl2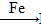 FeCl3
FeCl3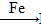 FeCl2,B为FeCl3,C为FeCl2,由于Fe2+易被氧化,储存FeCl2溶液时常加入少量铁粉。
FeCl2,B为FeCl3,C为FeCl2,由于Fe2+易被氧化,储存FeCl2溶液时常加入少量铁粉。
(3)A、B、C均含同一种金属元素,结合题意可推出,应是含铝化合物与酸或碱的反应。如:
NaAlO2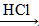 Al(OH)3
Al(OH)3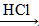 AlCl3或AlCl3
AlCl3或AlCl3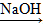 Al(OH)3
Al(OH)3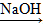 NaAlO2
NaAlO2
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般