1、选择题 在25 ℃时,某溶液中由水电离出的c(H+)=10-12mol·L-1。该溶液的pH可能为
A.12
B.7
C.6
D.4
2、填空题 (8分) 常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略体积的变化),测得混合溶液的pH=9。试回答以下问题:
(1)液的pH=9的原因是_________________________(用离子方程式表示);
(2)混合后的溶液中由水电离出的c(OH-)为a,pH=9 的NaOH溶液中由水电离出的c(OH-)为b,则a?b(填“>”、“<”或“=”),a︰b=?。
(3)在混合溶液中c(HA) + c(A-) = ??mol/L。
3、选择题 已知700C时纯水 ,下列叙述正确的是
,下列叙述正确的是
A.700C时,向纯水中加人H3PO4后,水的Kw减小
B.700C的Na2CO3溶液中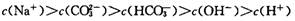
C.700C的H2S04溶液中
D.将室温下0.1 mol/L的NaOH溶液加热至700C时,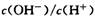 随之增大
随之增大
4、填空题 写出下列几种溶液的pH或pH的范围
(1)0.05mol/LH2SO4溶液?;(2)0.01mol/LNaOH溶液?
(3)pH=12NaOH溶液加水稀释100倍?;
(4))pH=5HCl溶液加水稀释1000倍?。
5、选择题 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1 mol·L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。下列说法错误的是( )
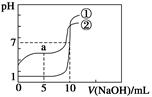
A.图中曲线①表示NaOH溶液滴定盐酸时的pH变化
B.酸溶液的体积均为10 mL
C.a点:c(CH3COOH)>c(CH3COO-)
D.a点:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)