1、选择题 在25 ℃时,某溶液中由水电离出的c(H+)=10-12mol·L-1。该溶液的pH可能为
A.12
B.7
C.6
D.4
参考答案:A
本题解析:在25 ℃时,某溶液中由水电离出的c(H+)=10-12mol·L-1,这说明该溶液中水的电离平衡是被抑制的,因此可能是酸溶液,也可能是碱溶液,因此该溶液的pH可能为2或12,答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查,试题贴近高考,注重解题的灵活性。该题的关键是明确外界条件是如何影响水的电离平衡的,有利于培养学生的逻辑推理能力和灵活应变能力。
本题难度:一般
2、填空题 (8分) 常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略体积的变化),测得混合溶液的pH=9。试回答以下问题:
(1)液的pH=9的原因是_________________________(用离子方程式表示);
(2)混合后的溶液中由水电离出的c(OH-)为a,pH=9 的NaOH溶液中由水电离出的c(OH-)为b,则a?b(填“>”、“<”或“=”),a︰b=?。
(3)在混合溶液中c(HA) + c(A-) = ??mol/L。
参考答案:(8分)
(1) A- + H2O 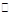 ?HA + OH-?(2分)
?HA + OH-?(2分)
(2) >? (2分)? 104 : 1? (2分)
(3) 0.05? (2分)
本题解析:略
本题难度:简单
3、选择题 已知700C时纯水 ,下列叙述正确的是
,下列叙述正确的是
A.700C时,向纯水中加人H3PO4后,水的Kw减小
B.700C的Na2CO3溶液中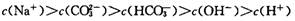
C.700C的H2S04溶液中
D.将室温下0.1 mol/L的NaOH溶液加热至700C时,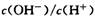 随之增大
随之增大
参考答案:C
本题解析:水的离子积常数只与温度有关,A不正确。碳酸钠水解显碱性,且水解分为两步c(OH-)应大于c(CO32-),B不正确。选项C符合电荷守恒,正确。将0.1 mol/L的NaOH溶液加热至700C时,溶液中的c(OH-)不变,但由于水的离子积常数增大,导致氢离子增大,所以选项D不正确。
本题难度:简单
4、填空题 写出下列几种溶液的pH或pH的范围
(1)0.05mol/LH2SO4溶液?;(2)0.01mol/LNaOH溶液?
(3)pH=12NaOH溶液加水稀释100倍?;
(4))pH=5HCl溶液加水稀释1000倍?。
参考答案:(1)? 1?;(2)? 12?
(3)? 10?;(4))PH接近7仍小于7? (其它合理叙述也可)。
本题解析:略
本题难度:一般
5、选择题 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1 mol·L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。下列说法错误的是( )
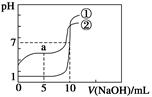
A.图中曲线①表示NaOH溶液滴定盐酸时的pH变化
B.酸溶液的体积均为10 mL
C.a点:c(CH3COOH)>c(CH3COO-)
D.a点:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)
参考答案:C
本题解析:①代表盐酸,②代表醋酸,A项正确;B项,向盐酸中加入10 mL NaOH时,pH=7,所以盐酸体积为10 mL,正确;C项,a点是CH3COOH和CH3COONa等物质的量混合,c(CH3COOH)<c(CH3COO-),错误;D项,符合电荷守恒,正确。
本题难度:一般