1、计算题 (6分)某学生准备用质量分数为37%、密度为1.19 g·cm-3的浓盐酸配制0.10 mol·L-1的稀盐酸500 mL。请完成下列问题:
(1)量取浓盐酸的体积为_________ mL,应选用量筒的规格为_________ mL。
(2)配制时应选用容量瓶的规格为_________ mL。
(3)需用的仪器有:容量瓶、___________、___________、___________和试剂瓶等。
参考答案:(1)4.1? 5或10
(2)500
(3)烧杯?玻璃棒?胶头滴管
本题解析:根据所配制稀盐酸的物质的量的浓度和体积可以算出溶质的物质的量,再根据溶质的物质的量和质量分数可以求出溶液的质量,根据溶液的质量和密度可以求出量取浓盐酸的体积;量筒的规格选用应该遵循与溶液体积接近的原则;根据所配制稀盐酸的体积可以选用容量瓶的规格;根据配制的各步骤可以确定需用的仪器。
本题难度:简单
2、选择题 下列气体中,既可用浓H2SO4干燥,又可用固体NaOH干燥的是
A.Cl2
B.NH3
C.SO2
D.O2
参考答案:D
本题解析: A.Cl2可以和氢氧化钠反应生成氯化钠、次氯酸钠和水,错误;B.氨气溶于水是氨水,能与浓硫酸反应,错误; C.SO2能与氢氧化钠反应生成亚硫酸钠和水,错误; D.O2既不与浓硫酸反应,也不与氢氧化钠反应,因此可以干燥,正确。
本题难度:一般
3、选择题 配制100mL1.0mol·L-1的NaOH溶液,下列情况不会影响溶液浓度的是(?)
A.容量瓶使用前有蒸馏水
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.俯视确定凹液面与刻度线相切
D.称量NaOH固体时使用了称量纸
参考答案:A
本题解析:A.容量瓶使用前有蒸馏水,不影响;?
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,损失溶质;
C.俯视确定凹液面与刻度线相切,溶液体积偏大;
D.称量NaOH固体时使用了称量纸,损失溶质;故选A。
点评:误差分析是要注意:误差的分析的决定式是C=n/v=m/Mv
关键是看实验操作过程中溶质有没有损失,溶液体积不变时,若溶质损失,分子减少所以C偏低;若溶质不损失,溶液体积减少,分母减小,所以C偏高;反之亦然。
本题难度:简单
4、填空题 高锰酸钾在实验室和医疗上有非常广泛的应用。以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
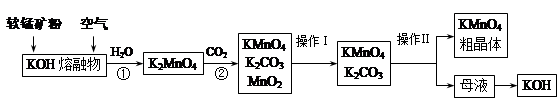
(1)上述生产过程中,第①步的氧化剂为(写化学式)?。
(2)第②步反应的化学方程式是?。
(3)由母液制得KOH应加入的物质是?。写出相应化学方程式?。
(4)操作Ⅰ用到的仪器有?,操作Ⅱ是根据KMnO4和K2CO3两种物质在?上的差异,采用蒸发结晶、趁热过滤得到KMnO4粗晶体。
参考答案:(1)O2
(2)3K2MnO4+2CO2= 2KMnO4+2K2CO3+MnO2
(3)Ba(OH)2或Ca(OH)2或CaO等;
Ca(OH)2+K2CO3= ?Ca CO3↓+2KOH(其他合理答案亦可)
(4)漏斗、烧杯、玻璃棒、铁架台(带铁圈);溶解度
本题解析:(1)上述生产过程中,第①步的反应为:2MnO2+4KOH(熔融)+O2?==2K2MnO4+2H2O,氧化剂为O2;(2)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,利用氧化还原方程式的配平原则可写出,3K2MnO4+2CO2= 2KMnO4+2K2CO3+MnO2(3)母液为K2CO3溶液,制取KOH应加入的物质是Ba(OH)2或Ca(OH)2或CaO等;(4)操作Ⅰ为过滤,用到的仪器为漏斗、烧杯、玻璃棒、铁架台(带铁圈),操作II是将两种可溶于性盐分离开,应该是利用物质溶解度的差异,通过浓缩结晶的方法将二者分离开。
本题难度:一般
5、选择题 下图是产生和收集气体的实验装置,该装置不适合于?

A.用锌和盐酸制取H2
B.用NH4Cl和Ca(OH)2制取NH3
C.用电石和饱和食盐水制取C2H2
D.用H2O2在MnO2催化下制O2
参考答案:B
本题解析:用NH4Cl和Ca(OH)2制取NH3,是固体混合物的反应,需要加热,故不能使用图中装置。
本题难度:一般