1、实验题 二茂铁(结构如图)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到。反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁的熔点为172~173℃,在100℃开始升华。能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定。制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5 mL环戊二烯,再搅拌10分钟。
步骤2. 向烧杯中加入25 mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中。
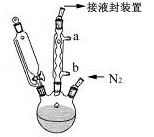
步骤3. 按图所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时。
步骤4. 反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全。
步骤5. 抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁。
(1)步骤1中通入N2的目的可能是?。
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是?。
(3)实验装置中,冷凝管通水,水应从?口进(选填a或b)。
(4)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是?。
(5)步骤5用冷水洗涤是因为?,因此可采用?的方法,进一步提纯二茂铁。
2、实验题 (12分)I.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙和一种氮肥。请根据要求答问题:
(1)写出该反应的化学方程式??。
(2)如何判断所得碳酸钙是否为纳米级???。
Ⅱ.某实验小组设计下图装置测定SO2转化成SO3的转化率。已知SO3的熔点16.8℃,沸点是44.8℃。已知发生装置中反应的化学方程式为:
Na2SO3(s)+H2SO4
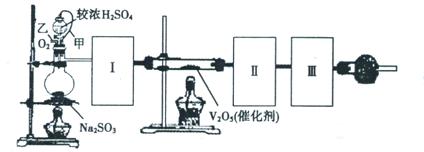
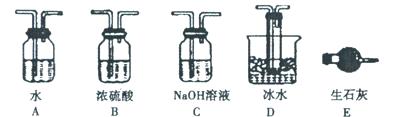
(1)根据实验需要,请从下图A~E装置中选择最适合装置,连接在I、Ⅱ、Ⅲ处。
Ⅰ?Ⅱ?Ⅲ?。
(2)在检查完装置气密性后,从乙处均匀通入O2,在实验中先加热催化剂后滴加浓硫酸,这样操作后在装置I和装置Ⅱ之间发生的反应的化学方程式?。
(3)发生装置的分液漏斗上接橡皮管甲的目的是?。
(4)用126g Na2SO3粉末与足量浓硫酸进行实验,当反应结束时,继续通入O2一段时间,若测得装置Ⅲ增重了51.2g,则实验中SO2的转化率为?。
3、填空题 (每空2分,共12分)实验室欲配制220mL 0.2 mol·L-1的碳酸钠溶液,回答下列问题:
可供选择的仪器:①量筒②胶头滴管③托盘天平④药匙⑤烧瓶⑥烧杯
(1)通过计算可知,应用托盘天平称取?g碳酸钠晶体(Na2CO3?10H2O)
(2)配制过程需要的仪器______________(填序号),还缺少的仪器有?
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)_____________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的Na2CO3固体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀