1、填空题 甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电。请完成下列与甲醇有关的问题。?
?工业上有一种生产甲醇的反应为:
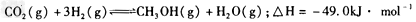
在温度和容积相同的A、B两个容器中,按不同方式投人反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表

(1)从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为_________。
(2)A中达到平衡时CO2的转化率为_________。
(3)a?=_________。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图
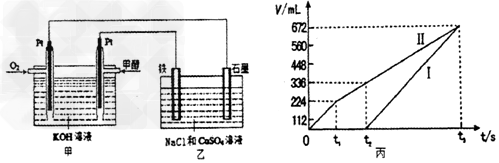
(4)写出甲中通入甲醇这一极的电极反应式__________________
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式__________________;在t2时所得溶液的pH为__________________。(假设溶液体积不变)
参考答案:(1)0.1c1?mol/(L·s)?或0.1c2?mol/(L·s)
(2)60%
(3)19.6
(4)CH3OH?-?6e-+?8OH-?=?CO32-+?6H2O
(5)4OH-?-4e-?=?O2↑+?2H2O;1
本题解析:
本题难度:一般
2、选择题 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol 硝酸锌时,被还原的硝酸的物质的量为
[? ]
A.2 mol
B.1 mol
C.0.5 mol
D.0.25 mol
参考答案:D
本题解析:
本题难度:一般
3、选择题 在3BrF3?+5H2O==HBrO3+Br2?+9HF+O2反应中,若有15mol?H2O作还原剂,则被水还原的BrF3的物质的量为
A.6 mol
B.12mol
C.4mol
D.10 mol
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列化学变化中需加入氧化剂才能实现的是
A.Fe→FeCl2
B.SO3→H2SO4
C.Cl2→ClO3-
D.KMnO4→MnCl2
参考答案:A
本题解析:试题分析:需要加入氧化剂才能发生的反应是氧化反应,化合价升高,A项Fe元素的化合价升高,符合,B项S元素的化合价不变,不符合,C项Cl2→ClO3-可以发生自身氧化还原反应,不需要特别加氧化剂,不符合,D项Mn的化合价降低,不符合。答案选A。
考点:氧化还原反应
点评:本题C项容易错选,Cl2可以发生歧化反应。
本题难度:困难
5、填空题 氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g) ==2H2O(l) ΔH=-572kJ/mol 。 请回答下列问题
(1)生成物能量总和__________(填“>”、“<”或“=”)反应物能量总和。
(2)若1mol氢气完全燃烧生成水蒸气,则放出的热量_________(填“>”、“<”或“=”)286kJ。
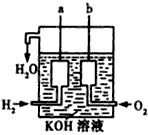
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造的一部分如图所示:a、b两个电极均由多孔的碳块组成。此装置的负极反应式为____________________,当正极消耗5.6L(标准状况)气体时,外电路转移的电子数为____________________。
参考答案:(1)<
(2)<
(3)H2-2e-+2OH-==2H2O;6.02×1023
本题解析:
本题难度:一般