1、选择题 离子反应方程式能表示物质在溶液中进行离子反应的实质。下列反应的离子方程式的书写中,正确的是
A.硫酸溶液与氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓
B.将少量过氧化钠放入水中:Na2O2+H2O =2Na++2OH-+O2↑
C.用小苏打治疗胃酸过多:HCO3- +H+ = CO2↑+H2O
D.向氢氧化钠溶液中通入足量SO2气体:2OH-+ SO2 = SO32-+ H2O
参考答案:C
本题解析:A中还有水生成,A不正确;B中没有配平,不正确;D中SO2过量,应该生成亚硫酸氢钠,所以正确的答案选C。
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:简单
2、选择题 下列反应的离子方程式书写中,正确的是( )
A.硫酸亚铁酸性溶液置于空气中变质:4Fe2++O2+4H+=4Fe3++2H2O
B.少量稀HNO3中加入足量铁粉:Fe+4H++NO3-=NO↑+Fe3++2H2O
C.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
D.硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
参考答案:A、亚铁离子具有还原性,能被氧气氧化为三价,即4Fe2++O2+4H+=4Fe3++2H2O,故A正确;
B、少量稀HNO3中加入足量铁粉反应最终生成的是亚铁离子,应为:3Fe+8H++2NO3-=2NO↑+3Fe2++4H2O,故B错误;
C、铝能和强碱反应生成偏铝酸钠和氢气,实质是:2Al+2OH-+2H2O=2AlO2-+3H2↑,故C错误;
D、氨水是弱碱,不能拆成离子形式,应为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误.
故选A.
本题解析:
本题难度:一般
3、选择题 下列离子方程式正确的是?
[? ]
A.用稀氢氧化钠溶液吸收二氧化氮:2OH-+3NO2=2NO3-+NO↑+H2O
B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2+ +2HCO3-+ 2OH-=CaCO3↓+CO32- +2H2O
C.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
D.苯酚与碳酸钠溶液的反应: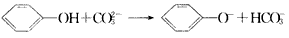
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列离子方程式正确的是( )
A.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
B.硫酸和氯化钡反应:Ba2++SO42-=BaSO4↓
C.氢氧化铜和硫酸反应:OH-+H+=H2O
D.铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu
参考答案:A、碳酸钙为难溶物质,应用化学式表示,则正确的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故A错;
B、硫酸与氯化钡均为易溶于水、易电离的物质拆写成离子形式,产物中硫酸钡为难溶物质用化学式表示,氯化氢为易溶于水、易电离的物质写成离子形式,故B正确;
C、氢氧化铜为沉淀仍用化学式,则正确的离子方程式为Cu(OH)2+2H+=2H2O+Cu2+,故C错;
D、铁与非氧化性的酸、盐溶液反应是表现+2价,即不符合客观事实,则正确的离子方程式为Fe+Cu2+=Fe2++Cu,故D错;
故选:B.
本题解析:
本题难度:简单
5、选择题 下列离子方程式书写正确的是( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.金属钠和水的反应:Na+2H2O=H2↑+Na++2OH-
C.Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+=Al3++3H2O
D.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
参考答案:A、离子反应要遵循电荷守恒,FeCl2溶液中通入Cl2,亚铁离子被氧化为三价,即2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B、离子反应要遵循原子守恒,金属钠和水的反应为:2Na+2H2O=H2↑+2Na++2OH-,故B错误;
C、酸和碱之间发生中和反应生成对应的盐和水,故C正确;
D、氢氧化铝不能溶于氨水中,AlCl3溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3H2O+3NH4+,故D错误.
故选C.
本题解析:
本题难度:一般