1、选择题 用下列装置进行的实验,不能达到相应实验目的的是
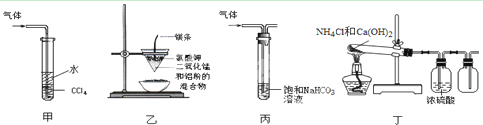
A.装置甲:吸收尾气HCl
B.装置乙:制取金属锰
C.装置丙:洗气除去CO2中的SO2
D.装置丁:实验室制取NH3
参考答案:D
本题解析:A、HCl极易溶于水,CCl4能防止倒吸,正确;B、铝热反应可以冶炼高熔点的金属,正确;C、亚硫酸的酸性强于碳酸,故SO2与碳酸氢钠反应生成CO2,正确; D、浓硫酸与氨气反应,不能用其干燥,错误。
本题难度:一般
2、选择题 除去下列物质中的少量杂质(括号内为杂质),所选试剂和分离方法合理的是
A.苯(苯酚):溴水、过滤
B.CO2气体(HCl):饱和Na2CO3溶液、洗气
C.淀粉(氯化钠):蒸馏水、渗析
D.水(Br2):乙醇、分液
参考答案:C
本题解析:A苯酚和溴水发生反应产生的三溴苯酚白色沉淀不溶解于水,但是溶解在苯中,所以不能通过过滤的方法进行分离提纯。错误。B.CO2气体(HCl):若用饱和Na2CO3溶液则杂质HCl会发生反应:2HCl +Na2CO3=2NaCl+H2O+ CO2↑.被提纯的物质也会发生反应: H2O+ CO2+Na2CO3=2NaHCO3。违背除杂的原则。错误。C.淀粉溶液属于胶体,胶体的分散质微粒的直径比溶液的大,可用半透膜通过渗析的方法除去其中氯化钠溶液。正确。D水和乙醇互溶,所以不能用乙醇来萃取水中的Br2单质。错误。
本题难度:一般
3、选择题 下列实验可行的是
[? ]
A.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
B.用食醋浸泡有水垢的水壶清除其中的水垢
C.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
D.用乙醇从碘水中萃取碘
参考答案:B
本题解析:
本题难度:一般
4、实验题 牙膏中的摩擦剂一般由CaCO3、Al(OH)3或SiO2组成。某小组对几种牙膏中摩擦剂成分及其含量进行探究:
(1)根据上述信息,推测摩擦剂应具备的性质有?
A.易溶于水? B.难溶于水? C.颗粒较大? D.颗粒较小
(2)已知A牌牙膏的摩擦剂是Al(OH)3,取少量牙膏样品,加水充分搅拌、过滤:
①往滤渣中加入过量NaOH溶液,Al(OH)3与NaOH溶液反应的离子方程式____?__。
②往①所得滤液先通入过量CO2,再加入过量稀盐酸,观察到的现象是?。
(3)已知B牌牙膏中摩擦剂可能含有一或两种物质,将此牙膏的摩擦剂溶于盐酸时,发现有不溶性物质。
① 对B品牌牙膏摩擦剂的成分提出合理假设:
假设1:只有SiO2?假设2:可能有SiO2和CaCO3
假设3:可能有________________。
② 请设计方案对B品牌牙膏摩擦剂的成分进行验证。填写下表。限选试剂:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水
实验步骤
| 预期现象和结论
|
步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B。
| ?
|
步骤2:
| ?
|
步骤3:
| ?
|
(4)已知C牌牙膏中的摩擦剂为CaCO3,为测定CaCO3的质量分数,取20.0g牙膏样品溶于水后过滤,将所得沉淀溶于100mL1mol/L的盐酸(假设所得溶液体积不变),从所得的溶液中取20.00mL,用1mol/L NaOH溶液进行滴定,消耗NaOH溶液5.00mL,则C品牌牙膏中CaCO3的质量分数为?_(保留四位有效数字)。.
参考答案:(1)B D(3分,选1个对的得1分,全对3分)
(2)①?Al(OH)3+OH-=AlO2-+2H2O(3分,未配平扣1分)(或Al(OH)3+OH-=[Al(OH)4]- )
②通入CO2气体有白色沉淀生成;加入盐酸有气体生成、沉淀溶解;(2分)(或:通入CO2气体有白色沉淀生成;加入盐酸沉淀溶解)
(3)①SiO2和Al(OH)3(或二氧化硅和氢氧化铝)(1分,少一种不得分)
②(4分)
实验步骤
预期现象和结论
步骤2:取适量沉淀B于试管中,滴加过量稀盐酸(1分)
出现无色气泡,说明含有碳酸钙(1分)
步骤3:取步骤2的上层清液,滴加氢氧化钠溶液(1分)
先生成沉淀,后沉淀溶解,说明含有氢氧化铝。(1分)
?
(4)18.75% (或0.1875)( 3分)
本题解析:(1)牙膏中的摩擦剂一般由CaCO3、Al(OH)3或SiO2组成,根据这几种物质的特点都难溶于水,推测用于刷牙的固体颗粒不会太大,所以答案选BD。
(2)①Al(OH)3难溶于水,书写离子方程式时不能拆开,所以Al(OH)3与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
②往①所得滤液先通入过量CO2,二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀,所以会看到有白色沉淀生成;再加入过量稀盐酸,稀盐酸和氢氧化铝发生中和反应,沉淀消失,同时溶液中的碳酸氢根离子与氢离子反应生成二氧化碳气体;
(3)①此牙膏的摩擦剂溶于盐酸时,发现有不溶性物质。说明一定含二氧化硅,3种物质中选择一种或2种其中必有二氧化硅的可能有3种,所以假设3应是可能有SiO2和Al(OH)3
②步骤1后得沉淀B,取适量B于试管中,加入稀盐酸,若固体不溶解,则为假设1;若固体部分溶解且有气体产生则为假设2;若固体部分溶解且无气体产生则为假设3。
或者取适量B于试管中,加入稀盐酸,有气体产生,证明有碳酸钙;取以上反应的清液,加入氢氧化钠溶液,先生成沉淀,后沉淀溶解,说明含有氢氧化铝。
(4)由消耗氢氧化钠的体积可计算100mL的溶液中剩余H+的物质的量是5×10-3L×1mol/L×5=0.025mol,则用于和碳酸钙反应的H+的物质的量是0.1L×1mol/L-0.025mol=0.075mol,由2H+~CaCO3得碳酸钙的物质的量是0.0375mol,所以样品中碳酸钙的质量是3.75g,则碳酸钙的质量分数是3.75g/20.0g×100%=18.75%。
本题难度:一般
5、选择题 现有一瓶物质是甲和乙的混合物,已知甲和乙的某些性质如下表所示:

据此,将甲和乙相互分离的最佳方法是
[? ]
A.萃取法?
B.过滤法
C.蒸馏法?
D.分液法
参考答案:C
本题解析:
本题难度:简单