1、简答题 某强酸性溶液X,含Ag+、Al3+、SiO2-3、NH+4、Fe2+、Fe3+、CO2-3、Cl-、NO-3中的一种或几种离子,取X溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液x中肯定含有的是:______;不能肯定的是:______;对不能确定是否存在的离子,可以另取x溶液于一支试管中,选择下列试剂中的某一种加入X溶液,根据现象就可判断,则试剂可以选(若多种选法中间加“或“字间隔):______.
①酚酞试剂,②石蕊试剂,③pH试纸,④KSCN溶液,⑤KMnO4溶液,⑥苯酚溶液
(2)气体G的化学式为:______;沉淀E的化学式为:______;沉淀J的化学式为:______.
(3)实验中,产生的气体A为无色,但如果暴露在空气中可以观察到的现象是:______;写出步骤①中生成气体A的离子方程式______.
(4)要使步骤②中,A、H2O、O2三种物质恰好发生化合反应,则A、H2O、O2物质的量之比是:______.
2、填空题 下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G?的浓溶液中会钝化;F的溶液中只含一种溶质.
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是______,R、X、T的原子半径从小到大的顺序为:______(用元素符号表示);T与X形成的化合物T2X2含有的化学键类型是:______.
(2)A和G等物质的量反应生成的产物的水溶液显______性,其原因用离子方程式表示为______;
(3)A和X2反应的化学方程式为______;金属甲与D溶液反应生成F的离子方程式为:______.
(4)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和一氧化碳反应转化为两种空气的成分,当有22.4L的E(标准状况)转化时,转移的电子数为______NA.
3、简答题 已知A是一种由两种阳离子和一种酸根离子组成的含结晶水的复盐,现有以下实验:①用热的铂丝蘸取A的晶体在酒精灯火焰上灼烧,火焰呈紫色;②向A的水溶液中滴加稀盐酸,没有现象,再滴加氯化钡溶液有白色沉淀B产生;③向A的水溶液中加入过量氨水,产生白色沉淀C,将沉淀C加热,得到白色固体D,D既可溶于NaOH溶液,又可溶于硫酸;电解熔融的D可得到一种人们生产和生活中广泛使用的金属.请回答以下问题:
(1)B、C、D的化学式分别是______、______、______.
(2)请完成以下离子方程式或化学方程式:
①产生B的离子方程式______
②D分别溶于NaOH溶液和硫酸的化学方程式______,______.
4、推断题 已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料。它们有如图所示的转化关系。试回答下列问题?
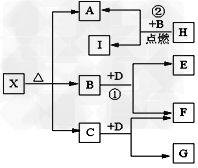
⑴X的化学式为:______________?;G的电子式为_______________?。
⑵写出下列反应的化学方程式 ①____________________?; ②__________________。
⑶H与同周期原子序数比其大一的另一种金属组成原电池,H作正极,则负极反应式为___________,电解质溶液为______________。
⑷H的工业制法可用电解原理,当阳极产生可使湿润的淀粉KI试纸变蓝的气体 1.12升(标况)时,阴极生成H____________克,有关化学方程式为________________。
5、填空题 (11分)、A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示。
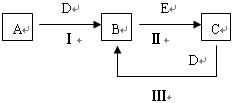
⑴若 A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体。①写出E的化学式?;
A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体。①写出E的化学式?;
②写出反应Ⅰ的化学方程式?。
⑵若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10 电子粒子
电子粒子
①写出A的电子式?
②写出反应Ⅱ的化学方程式?
⑶若A是地壳中含量最多的金属,B在火焰上灼烧时火焰呈黄色,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀
①写出B的化学式?②写出反应Ⅲ的离子方程式?
⑷若A是黑色粉末,常温 下B是黄绿色气体,C溶液呈碱性,有漂白性。
下B是黄绿色气体,C溶液呈碱性,有漂白性。
写出反应Ⅲ的离子方程式?;