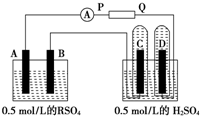
1、简答题 如图所示是表示两种溶液进行电解的装置:
电极A由金属R制成,R的硫酸盐的化学式为RSO4,B、C、D都是Pt,P和Q是电池的两极,电路接通后,R沉积于电极B上,同时电极C、D上产生气泡.
(1)电池的正极是______.
(2)A电极上的反应式是______.
(3)罩在电极C、D上的两试管中收集到气体的体积比是______.
(4)当电流强度为2A,通电3min13s后,电极B上生成金属R0.127g.已知1mol电子的电量为96500C,则R的相对原子质量为______,它是______(填元素符号).
(5)将P和Q变换位置接线,使电流方向反过来,电流强度为2A,5min后在B极上看到了______、______两种现象.
参考答案:(1)电路接通后,R沉积于电极B上,说明B电极上得电子发生还原反应,所以B极是电解池的阴极,A极阳极,P是电源的正极,Q是电源的负极,
故答案为:P;
(2)A电极上金属失电子生成金属阳离子而发生氧化反应,电极反应式为R-2e-═R2+,
故答案为:R-2e-═R2+;
(3)C、D电极都是Pt,电解硫酸溶液,C、D分别是电解池的阳极和阴极,分别放出O2、H2,它们的体积比为1:2,故答案为:1:2;
(4)根据Q=It=2A×(3×60+13)s=386C,1mol电子的电量为96500C,所以析出金属时转移电子的物质的量=386C96500C/mol=0.004mol,根据其硫酸盐的化学式知,R在化合物中显+2价,则析出金属的物质的量=0.04mol2=0.02mol,R的相对原子质量=0.127g0.02mol=63.5g/mol,则其相对原子质量为63.5,所以是Cu,
故答案为:63.5;Cu;
(5)将P和Q变换位置接线后,B极成为电解池的阳极,在前3min13s原来析出的Cu发生反应Cu-2e-═Cu2+而溶解,后1min47s发生反应4OH--4e-═2H2O+O2↑而产生氧气,所以看到的现象是金属R(Cu)溶解;B极上有气泡逸出,故答案为:金属R(Cu)溶解;B极上有气泡逸出.
本题解析:
本题难度:简单
2、选择题 下图是一种新型的质子交换膜二甲醚燃料电池(DDFC)。电池总反应为:CH3OCH3+3O2=2CO2+3H2O,下列说法不正确的是
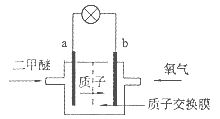
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.电池工作时,1 mol二甲醚被氧化时就有6 mol电子转移
参考答案:D
本题解析:本题考查燃料电池。通入燃料甲醚的a电极是原电池的负极,甲醚失电子发生氧化反应,通入氧气的b电极是正极,氧气得电子发生还原反应,电流从正极沿导线流向负极。A、燃料电池中,通入燃料甲醚的电极a是负极,正确;B、电池工作时电流由正极b沿导线到负极a,正确;C、通入氧气的电极是正极,在酸性环境下的电极反应为:4H++O2+4e-=2H2O,正确;D、根据电池反应CH3OCH3+3O2=2CO2+3H2O可知,1mol甲醚被氧化时就有12mol电子转移,错误。
本题难度:一般
3、实验题 (13分)某课外小组探究钠、铝、铁、铜单质还原性强弱及其相关化学性质,做了如下实验:
实验1
| 常温时取四种金属少量分别放入装有蒸馏水的试管中
|
实验2
| 再取少量铝、铁、铜分别放入装有稀硫酸的试管中
|
(1)实验1中能发生反应的离子方程式 。
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是 。
结论:由实验1、2得出四种金属的还原性强弱顺序为 ;请从原子结构角度解释钠的还原性强于铝 。
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液加入过量的NaOH溶液,写出反应的离子方程式 。
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是 。
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案 。
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置。
①画出原电池的装置图 。
②该电池的正极反应为 。
参考答案:(13分)
(1)2Na+2H2O=2Na++2OH-+H2↑ (2分)
(2)铝、铁均产生气泡且铝稍快些,铜不产生气泡 (1分)
Na>Al>Fe>Cu (1分)
Na、Al同属于第三周期Na原子半径大于Al (1分)
(3)① Al3++4OH-=AlO2-+2H2O (2分)
②b (1分)
(4)将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗(其它答案合理给分) (2分)
(5)① ②2Fe3++2e-=2Fe2+ (1分)
②2Fe3++2e-=2Fe2+ (1分)
本题解析:(1)钠、铝、铁、铜四种金属中常温下只有钠与水反应,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;(2)铝、铁与稀硫酸反应生成氢气且铝快些,铜与稀硫酸不反应;结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;Na、Al同属于第三周期Na原子半径大于Al,钠更易失去电子;(3)①Al3+与过量的NaOH溶液反应的离子方程式Al3++4OH-=AlO2-+2H2O ;②通常可用K3[Fe(CN)6]溶液检验Fe2+,简便易操作,答案选b;(4)可通过原电池原理,氧化还原反应原理进行检验;(5)①应用Fe作负极,铜作正极,氯化铁溶液作电解质溶液,装置图略;②该电池的正极发生还原反应,电极反应为2Fe3++2e-=2Fe2+。
考点:常见金属的性质、原电池原理
本题难度:困难
4、选择题 在潮湿的空气中,钢铁很快发生电化学腐蚀,在此过程中一定不存在的电极反应是
[? ]
A.2H++2e-==H2↑
B.Fe-3e-==Fe3+
C.Fe-2e-==Fe2+
D.O2+2H2O+4e-==4OH-
参考答案:B
本题解析:
本题难度:简单
5、填空题 以氯化钾和硫酸亚铁原料生产硫酸钾和氧化铁红颜料,其主要流程如下:
已知: 溶液呈碱性,30℃以上溶液中
溶液呈碱性,30℃以上溶液中 大量分解。
大量分解。

(1)写出 溶液中的物料守恒___________________________________
溶液中的物料守恒___________________________________
(2)写出沉淀池I中反应的化学方程式_______________________,该反应必须控制的反应条件是___________________________。
(3)检验沉淀I中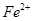 沉淀是否完全的方法是__________________________________。
沉淀是否完全的方法是__________________________________。
(4)酸化的目的是___________________________。
(5)在沉淀池II中,为使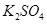 晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
(6)N、P、K、S都是植物生长所需的重要元素。滤液A可做复合肥料,因为其中含有___________等元素。
(7)中国海洋大学应用化学研究所在乙醇燃料电池技术方面获得突破,组装出了自呼吸电池及主动式电堆。乙醇燃料电池的工作原理如图怕示。
①该电池工作时,c口通入的物质为___________。
②该电池负极的电极反应式为_____________________________________。

参考答案:(1)[NH4+]+[NH3?H2O]=[CO32?]+[H2CO3]+[HCO3?] (2分)
(2)2NH4HCO3 + FeSO4 = FeCO3↓+ (NH4)2SO4 + CO2↑+ H2O (2分);反应温度低于30℃ (1分)
(3)取沉淀池Ⅰ的滤液,滴加KSCN溶液后滴加氯水,若无红色出现,说明沉淀完全。(合理即可)(2分)
(4)除去溶液中的HCO3? (2分)
(5)普通漏斗、烧杯、玻璃棒(2分 不全得1分,下同)
(6)K、S 、K?(2分)
(7)O2(1分);C2H6O – 12e? + 3H2O = 2CO2 +12H+(2分)
本题解析:(1)物料守恒的实质是元素守恒,NH4HCO3溶液中N元素与C元素物质的量相等,所以[NH4+]+[NH3?H2O]=[CO32?]+[H2CO3]+[HCO3?]
(2)碳酸氢根离子和亚铁离子之间发生双水解反应生成碳酸亚铁沉淀,并放出二氧化碳,反应的原理方程式为:2NH4HCO3+FeSO4=FeCO3↓+(NH4?)2SO4+CO2↑+H2O,为防止较高温度下碳酸氢铵的分解,要注意温度的选择,反应温度低于30℃。
(3)亚铁离子可以被氯气氧化为三价铁离子,亚铁离子遇到硫氰酸钾不显色,但是三价铁遇到硫氰酸钾显示红色,检验沉淀池I中Fe2+沉淀是否完全的方法是:取沉淀池I的滤液,滴加KSCN溶液后滴加氯水,若无红色出现,说明沉淀完全。
(4)沉淀池Ⅰ中,除了生成的碳酸亚铁之外,溶液汇总会含有过量的碳酸氢铵,加入酸,酸化的目的是除去溶液中的HCO3-。?
(5)由题目看出在Ⅲ反应中生成的K2SO4为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
(6)滤液A的成分中含有(NH4?)2SO4以及KCl,即含有N、S、K元素,属于复合肥料。
(7)根据图中H+移动方向,可知右侧电极为燃料电池的正极,所以c口通入的物质为O2;由图可知电解质溶液中含H+,所以乙醇和水反应,根据化合价的变化,C2H5OH失去12e?,可得电极方程式:C2H6O – 12e? + 3H2O = 2CO2 +12H+
本题难度:一般