1、填空题 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子
| 开始沉淀的pH
| 沉淀完全的pH
|
Fe3+
| 1.1
| 3.2
|
Al3+
| 3.0
| 5.0
|
Fe2+
| 5.8
| 8.8
|
?
(1)制备FeCO3时,选用的加料方式是?(填字母),原因是?。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是?。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。①铁粉的作用是?。
②反应结束后,无需过滤,除去过量铁粉的方法是?。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是?。
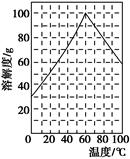
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,?,得到FeSO4溶液,?,得到FeSO4·7H2O晶体。
2、填空题 金属铁在空气中缓慢氧化生成的产物是?(化学式),在O2中燃烧生成的产物是?(化学式),铁与水蒸气发生反应的化学方程式是?
3、填空题 mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水完全吸收,m和n的关系是什么?
4、填空题 MnO2一种黑色粉末,既可用于实验室制O2的催化剂,又可以用于实验室制Cl2.某化学实验小组通过实验来探究一黑色粉末是否由MnO2、FeO组成(不含有其它黑色物质).探究过程如下:
提出假设:假设1.黑色粉末是MnO2;假设2.黑色粉末是FeO;假设3.______.
设计探究实验:
取少量粉末放入足量的稀硫酸中,充分反应后.
(1)若假设1成立,则实验现象是______.
(2)若黑色粉末全部溶解,所得溶液显______,则假设______成立.
(3)若产生______的现象,则假设3成立.
有另一小组同学提出,若混合物中FeO含量很少,可能加入足量的稀硫酸后实验现象不明显,就无法假设3是否成立.
(4)为探究假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氯水,再加入KSCN试剂,若产生______现象,则假设3成立.
5、选择题 将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。已知Fe + 2Fe3+= 3Fe2+,Cu + 2Fe3+= 2Fe2++Cu2+。则原混合物中单质铁的质量是(?)
A.2.4 g
B.3.36 g
C.5.60 g
D.10.08 g