1、填空题 柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子
| 开始沉淀的pH
| 沉淀完全的pH
|
Fe3+
| 1.1
| 3.2
|
Al3+
| 3.0
| 5.0
|
Fe2+
| 5.8
| 8.8
|
?
(1)制备FeCO3时,选用的加料方式是?(填字母),原因是?。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是?。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。①铁粉的作用是?。
②反应结束后,无需过滤,除去过量铁粉的方法是?。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是?。
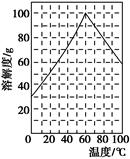
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,?,得到FeSO4溶液,?,得到FeSO4·7H2O晶体。
参考答案:(1)c 避免生成Fe(OH)2沉淀
(2)取最后一次的洗涤滤液1~2 mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
(3)①防止+2价的铁元素被氧化 ②加入适量柠檬酸让铁粉反应完全
(4)降低柠檬酸亚铁在水中的溶解量,有利于晶体析出
(5)“(过滤,)向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤”或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤” (滴加稀硫酸酸化,)加热浓缩得到60 ℃饱和溶液,冷却至0 ℃结晶,过滤,少量冰水洗涤,低温干燥
本题解析:本题考查化学实验,意在考查考生的实验操作能力及实验设计能力,同时考查了考生对铁及其化合物性质的理解与应用能力。(1)碳酸钠溶液水解显碱性,Fe2+在碱性环境中会生成氢氧化亚铁沉淀,故应在硫酸亚铁中加入碳酸钠溶液。(2)检验FeCO3沉淀是否洗涤干净,即检验洗涤液中是否含有SO42-,可以用酸化的氯化钡溶液检验,若无白色沉淀产生,则表明已洗涤干净。(3)Fe2+具有还原性,易被空气中的氧气氧化,加入铁粉可以防止其被氧化。铁可与酸(柠檬酸)反应,故可用柠檬酸直接处理多余的铁粉,使之生成柠檬酸亚铁。(4)加入乙醇可以抑制柠檬酸亚铁在水中的溶解,提高柠檬酸亚铁的产率。(5)硫铁矿烧渣与稀硫酸反应,生成硫酸铁和硫酸铝,二氧化硅不溶于稀硫酸,故接下来的操作是“过滤”,滤液中含有铁离子和铝离子,向滤液中加入足量的强碱,铁离子以沉淀的形式析出,铝元素以偏铝酸根离子的形式存在于溶液中,再过滤,滤渣为氢氧化铁,加硫酸得到硫酸铁,然后再加铁粉生成硫酸亚铁;最后加热浓缩、冷却结晶、过滤、洗涤、低温干燥,即得硫酸亚铁晶体(绿矾)。
本题难度:困难
2、填空题 金属铁在空气中缓慢氧化生成的产物是?(化学式),在O2中燃烧生成的产物是?(化学式),铁与水蒸气发生反应的化学方程式是?
参考答案:(4分)?Fe2O3?Fe3O4?;各1分? 3 Fe+4H2O(g)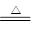 Fe3O4+ 4H2↑? 2分
Fe3O4+ 4H2↑? 2分
本题解析:金属铁在空气中缓慢氧化生成的产物是氧化铁,而在氧气中燃烧生成物是四氧化三铁。在加热的条件下,铁和水蒸气反应生成的是四氧化三铁和氢气,反应的化学方程式是3 Fe+4H2O(g)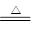 Fe3O4+ 4H2↑。
Fe3O4+ 4H2↑。
点评:该题是常识性知识的考查,试题基础性强,难度不大,有利于培养学生的规范答题能力,该题的关键是熟练记住铁的化学性质。
本题难度:一般
3、填空题 mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水来源:91考试网 91eXAm.org完全吸收,m和n的关系是什么?
参考答案:O.2m≤n≤O.3m
本题解析: 此题看起来,涉及的化学反应相当复杂,因HNO3的浓度和用量不同,生成Fe(NO3)3还是Fe(NO3)2不能确定,HNO3的还原产物是NO还是NO2也不能确定。所以消耗的氧气也无从下手求出.但是从始态和终态来看,HNO3的还原产物与氧气混合后,最终还是生成HNO3,这样消耗的氧气相当于把mg铁粉氧化成+2价或+3价化合物,用极端思考法很容易求出。
此题看起来,涉及的化学反应相当复杂,因HNO3的浓度和用量不同,生成Fe(NO3)3还是Fe(NO3)2不能确定,HNO3的还原产物是NO还是NO2也不能确定。所以消耗的氧气也无从下手求出.但是从始态和终态来看,HNO3的还原产物与氧气混合后,最终还是生成HNO3,这样消耗的氧气相当于把mg铁粉氧化成+2价或+3价化合物,用极端思考法很容易求出。

 假设HNO3为稀的,铁与HNO3反应后的价态是+2,
假设HNO3为稀的,铁与HNO3反应后的价态是+2,
 ?则有:? 3 Fe +8 HNO3=" 3" Fe(NO3)2 + 2 NO↑+ 4 H2O? (1)
?则有:? 3 Fe +8 HNO3=" 3" Fe(NO3)2 + 2 NO↑+ 4 H2O? (1)
 ? 4NO +3O2 +2H2O=4HNO3?(2)
? 4NO +3O2 +2H2O=4HNO3?(2)
 (1)×2 +(2)得:2Fe + O2 +4HNO3= 2Fe(NO3)2 +2H2O
(1)×2 +(2)得:2Fe + O2 +4HNO3= 2Fe(NO3)2 +2H2O
 ?可改写为 : 2Fe + O2 +4HNO3 ="?" 2FeO + 4HNO3
?可改写为 : 2Fe + O2 +4HNO3 ="?" 2FeO + 4HNO3
 ?即:? 2Fe + O2 =2FeO
?即:? 2Fe + O2 =2FeO
 ?同理可得 :? 4Fe +3O2=2Fe2O3?问题便得以解决
?同理可得 :? 4Fe +3O2=2Fe2O3?问题便得以解决
 即 :当铁被氧化为+2价时,由电子得失守衡得:
即 :当铁被氧化为+2价时,由电子得失守衡得:
 ? m/56×2=n/22.4×4? n=O.2m
? m/56×2=n/22.4×4? n=O.2m
 当铁被氧化为=+3价时,由电子得失守衡得:
当铁被氧化为=+3价时,由电子得失守衡得:
 ? m/56×3=n/22.4×4? n="O.3m?"
? m/56×3=n/22.4×4? n="O.3m?"
 则m与n的关系是:O.2m≤n≤O.3m
则m与n的关系是:O.2m≤n≤O.3m
本题难度:一般
4、填空题 MnO2一种黑色粉末,既可用于实验室制O2的催化剂,又可以用于实验室制Cl2.某化学实验小组通过实验来探究一黑色粉末是否由MnO2、FeO组成(不含有其它黑色物质).探究过程如下:
提出假设:假设1.黑色粉末是MnO2;假设2.黑色粉末是FeO;假设3.______.
设计探究实验:
取少量粉末放入足量的稀硫酸中,充分反应后.
(1)若假设1成立,则实验现象是______.
(2)若黑色粉末全部溶解,所得溶液显______,则假设______成立.
(3)若产生______的现象,则假设3成立.
有另一小组同学提出,若混合物中FeO含量很少,可能加入足量的稀硫酸后实验现象不明显,就无法假设3是否成立.
(4)为探究假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氯水,再加入KSCN试剂,若产生______现象,则假设3成立.
参考答案:根据假设1、2,则假设3应为黑色粉末是MnO2和FeO的混合物,故答案为:黑色粉末是MnO2和FeO的混合物
(1)MnO2与稀硫酸不反应,则假设1成立时,黑色粉末不溶解,溶液不显浅绿色,
故答案为:黑色粉末不溶解,溶液不显浅绿色;
(2)若黑色粉末全部溶解,所得溶液显浅绿色,则一定不含二氧化锰,假设2成立,故答案为:显浅绿色;2;
(3)如果是假设3成立,FeO溶于稀硫酸,溶液显浅绿色,但MnO2不溶解,则产生黑色粉末部分溶解,溶液显浅绿色,
故答案为:黑色粉末部分溶解,溶液显浅绿色;
(4)氯水具有氧化性,能将亚铁离子氧化为三价铁,由于Fe3+遇KSCN溶液变血红色溶液,现象十分明显,故可通过检验
Fe3+来确定FeO存在,故答案为:黑色粉末未全部溶解,溶液变血红色.
本题解析:
本题难度:简单
5、选择题 将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。已知Fe + 2Fe3+= 3Fe2+,Cu + 2Fe3+= 2Fe2++Cu2+。则原混合物中单质铁的质量是(?)
A.2.4 g
B.3.36 g
C.5.60 g
D.10.08 g
参考答案:C
本题解析:因有固体残余,没有Fe3+;故溶液只有FeCl2和过量HCl;根据氯离子守恒有n(FeCl2)=(0.1L×4.4mo/L-0.2L×0.4mol/L)÷2=0.18mol。产生氢气为0.04mol,故与之反应的铁为0.04mol;因有氢离子剩余,故1.28g为铜,与之反应的铁为0.02mol;在反应Fe + 2Fe3+= 3Fe2+中生成的Fe2+为0.18-0.04-0.02=0.12mol;则反应的铁为0.04mol。共有铁为0.04+0.04+0.02=0.1mol。
本题难度:简单