1、选择题 现有一定量的铁粉和铜粉的混合物,将其平均分成四等份,分别加入同浓度不同体积的稀硝酸,充分反应后,在标准状况下生成NO的体积和剩余金属的质量如下表(假设硝酸的还原产物只有NO一种):?
编号
| ①
| ②
| ③
| ④
|
稀硝酸体积/mL
| 100
| 200
| 300
| 400
|
剩余金属/g
| 18.0
| 9.6
| 0
| 0
|
NO体积/mL
| 2240
| 4480
| 6720
| V
|
根据上表中的数据计算分析,下列推断正确的是(?)
A.①中溶解了5.6 g Fe?B.②中溶解了9.6 g Cu
C.硝酸的浓度为4 mol/L?D.④中V = 6720
参考答案:C
本题解析::由第一组数据可知固体有剩余.无论硝酸和什么金属反应,根据N原子守恒得,n(HNO3)="4" n(NO).
加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,所以c(HNO3)=4mol/L.
故:c(HNO3)="4mol/L"
由1、2两组数据分析,两次剩余物的质量相差8.4g,此时生成2.24 LNO气体(转移0.3mol电子).
若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g.由此可知,当加入200ml硝酸溶液时,均溶解的是金属铁:
再由2、3两组数据分析,剩余的9.6g金属又恰好被等量的硝酸所溶解
综合可知,每份混合物中铁粉的质量为8.4×2=16.8g,即0.3mol;铜粉的质量为9.6g,即0.15mol;
④中,除了金属与硝酸生成的6720mlNO(0.3mol)气体外,溶液中的0.3mol的Fe2+也可被硝酸氧化,同时产生NO气体,由电子得失守恒可知NO为0.1mol,共0.4mol,8960ml
综上所述,答案为C
本题难度:一般
2、选择题 为了证明硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
参考答案:B
本题解析:A中有液体生成,基本上能断定是水,A正确;B中氨气溶于显碱性,应用湿润红色石蕊试纸检验,B错;C中选加入盐酸排除其它离子的干扰,再加入BaCl2,生成白色沉淀,证明有SO42-,C正确;D是检验Fe3+通常所用最合理的方法。答案选B。
本题难度:简单
3、填空题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.?请回答该实验中的问题.
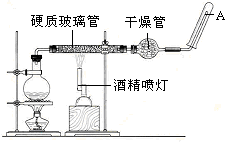
(1)写出该反应的化学方程式______,其中氧化剂是______,还原剂是______.8.4g铁粉参加反应,转移电子______mol.
(2)玻璃管中石棉绒的作用是______,实验开始时应先点燃______,实验结束时应先熄灭______.
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是______;烧瓶底部应事先放置______,其作用是______.
参考答案:(1)铁与水蒸气发生氧化还原反应:3Fe+4H2O?△?.?Fe3O4+4H2,根据化合价升降来判断氧化剂和还原剂.因铁的化合价升高,所以铁作还原剂,水中氢的化合价降低,水作氧化剂;根据3Fe+4H2O(g)?△?.?Fe 3O4+4 H2;方程式中反应3mol铁原子转移8个电子,设转移电子物质的量为X,
? 3Fe≈8e-
3×56? 8
8.4g? x
3×568.4g=8x
解得:x=0.4mol,
故答案为:3Fe+4H2O(g)?△?.?Fe 3O4+4H2;H2O;Fe;0.4;
(2)增大铁粉与水蒸气的接触面;点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯,
故答案为:铁粉的载体,增大铁粉与水蒸气的接触面;酒精灯;酒精喷灯;
(3)因为反应物为水蒸气与铁,所以这里加热的目的就是提供水蒸气,烧瓶底部应事先放置碎瓷片,放碎瓷片的目的是防止沸腾事故发生,
故答案为:为实验提供水蒸气;碎瓷片;防止暴沸.
本题解析:
本题难度:简单
4、实验题 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________。简述你的理由(不需写出反应方程式)____________
________________________________________________________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是________,写出发生反应的离子方程式________________________________。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1.4
|
沉淀完全pH
| 13
| 14
| 3.7
|
?
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
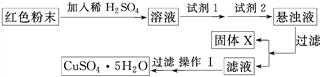
试回答:
①试剂1为________(填字母,后同),试剂2为________。
②固体X的化学式为____________________________________________________。
③操作Ⅰ为___________________________________________________________。
参考答案:(1)溶液变为血红色
(2)不合理 Cu能将Fe3+还原为Fe2+
(3)Fe2O3和Cu2O的混合物
Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+
(4) 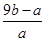 ×100%
×100%
(5)①B D ②Fe(OH)3 ③加热蒸发
本题解析:(1)若假设1成立,则溶液中含有Fe3+,遇到KSCN溶液显红色。(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu能与Fe3+反应生成Fe2+和Cu2+,故此种说法不正确。(3)若固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu。(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数。(5)根据题给表格可知,Fe(OH)3完全沉淀时,pH最小,故应将Fe2+先转化为Fe3+,再利用增大pH的方法除去溶液中的Fe3+,但是所加物质不能增加新的杂质,故第一步氧化剂应是H2O2,再加入Cu2(OH)2CO3,调节pH,使溶液中的Fe3+生成沉淀除去。
本题难度:一般
5、计算题 氧化铁和铁粉的混合物19.2 g,恰好溶于150 mL某浓度的稀硫酸,并收集到3.36 L(标准状况下)的气体。向反应后的溶液中滴加硫氰化钾溶液,不显血红色。求:
(1) 原混合物中铁粉的质量。
(2) 稀硫酸的物质的量浓度。
参考答案:(1)铁粉11.2g? (2)2mol/L
本题解析:二元混合物的题可以采用二元一次方程组来解。
设Fe2O3 Fe的物质的量分别为x、 y,向反应后的溶液中滴加硫氰化钾溶液,不显血红色,说明铁元素全部转化为二价铁
Fe2O3 +3H2SO4= Fe2(SO4)3+3H2O
1mol-------------1mol
xmol-------------xmol
Fe2(SO4)3 + ?Fe ?===== 3FeSO4
1mol-------1mol
xmol-------xmol
Fe ?+ H2SO4?=====?FeSO4?+ H2
1mol---------------1mol
(y-x)mol-----------3.36/22.4mol
(y-x)=3.36/22.4
160x+56y=19.2
x=0.05mol
y=0.2mol
原混合物中铁粉的质量为0.2mol*56g/mol=11.2g
(2)由于反应后铁元素全部转化为二价铁,硫酸恰好完全反应,所以反应后的溶液中只有硫酸亚铁,根据铁元素和硫酸根守恒可知
n(Fe) == n(FeSO4) == n(H2SO4) == 0.05*2 + 0.2 == 0.3mol
C(H2SO4) == 0.3mol/0.15L == 2mol/L
本题难度:一般