1、选择题 十九世纪初,法国科学家库图瓦正在家中做实验,一只猫把盛装海藻灰溶液和硫酸溶液的瓶子都碰翻了,他看到了一个奇异的现象:打翻在地的混合液里产生了一种紫色蒸气,气味十分难闻、呛鼻,而且紫色蒸气遇冷物体后变为紫黑色闪着金属光泽的晶体。库图瓦又做了许多实验,终于弄明白这种气体是一种新发现的元素,这种元素是
( )
A.碘
B.碳
C.铜
D.汞
参考答案:
A
本题解析:
由于该物质的蒸气呈紫色,且冷却后容易形成具有金属光泽的晶体,所以该物质为碘单质。
本题难度:一般
2、选择题 一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL、0.6mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,参加反应的氢气和所用氯气的物质的量之比为( )
A.2:3
B.3:2
C.3:1
D.3:4
参考答案:500mL、0.6mol/L的NaOH溶液中含有氢氧化钠的物质的量0.5L×0.6mol/L=0.3mol.
混合气体通入含0.3molNaOH的溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)=0.3mol,所以n(Cl2)=12×0.3mol=0.15mol.
由于由于溶液中n(ClO-)=0.05mol,所以溶液中n(Cl-)=0.3mol-0.05mol=0.25mol;
令氯气与氢氧化钠反应生成的氯离子的物质的量为xmol,根据电子转移守恒有x=0.05mol,
溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,所以氯化氢提供的氯离子为0.25mol-0.05mol=0.2mol,
即反应后的混合气体中n(HCl)=0.2molmol,根据氢元素守恒可知,n(H2)=12n(HCl)=12×0.2mol=0.1mol,
所以参加反应的氢气和所用氯气的物质的量之比为0.1mol:0.15mol=2:3.
故选:A.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是
A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有还原性
B.粗锌与稀硫酸反应比纯锌快,说明粗锌反应时形成了原电池
C.硬水含有Ca2+、Mg2+、HCO3-、SO42-,煮沸可以完全除去其中的Ca2+、Mg2+
D.pH相同的两种一元酸HA溶液和HB溶液与足量Zn反应,HA比HB反应速率快,说明HA酸性更强
参考答案:B
本题解析:漂白粉中滴入70%的硫酸,立刻产生黄绿色气体次氯酸受热分解产生氯气。硬水煮沸无法完全除去其中的Ca2+、Mg2+,只是将其软化。pH相同的两种一元酸HA溶液和HB溶液与足量Zn反应,HA比HB反应速率快,说明HA酸性更强或者浓度高。
本题难度:简单
4、选择题 如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O。对实验现象的“解释或结论”正确的是(?)
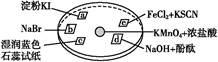
选项
| 实验现象
| 解释或结论
|
A
| a处变蓝,b处变红棕色
| 氧化性:Cl2>Br2>I2
|
B
| c处先变红,后褪色
| 氯气与水生成了酸性物质
|
C
| d处立即褪色
| 氯气与水生成了漂白性物质
|
D
| e处变红色
| 还原性:Fe2+>Cl-
|
?
参考答案:D
本题解析:a处变蓝,b处变红棕色,说明Cl2分别与KI、NaBr作用生成I2、Br2,可证明氧化性:Cl2>I2,Cl2>Br2,无法证明I2与Br2之间氧化性的强弱,A项错误;c处先变红,说明氯气与水生成酸性物质,后褪色,则证明氯气与水生成具有漂白性物质,B项错误;d处立即褪色,也可能是氯气与水生成酸性物质中和了NaOH,C项错误;e处变红说明Cl2将Fe2+氧化为Fe3+,证明还原性:Fe2+>Cl-,D项正确。
本题难度:一般
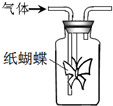
5、选择题 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
| A | B | C | D
喷洒液
酚酞
紫色石蕊
酸性重铬酸钾
酸化的KI-淀粉
通入的气体
NH3
Cl2
CH3CH2OH(g)
O2
预测的颜色变化
变为红色
最终褪色
无明显变化
变为蓝色
|
A.A
B.B
C.C
D.D