1、选择题 已知:2Zn(s)+O2(g)==2ZnO(s) △H=-701.0 kJ·mol-1
2Hg(l)+O2(g)==2HgO(s) △H=-181.6 kJ·mol-1
则反应Zn(s)+ HgO(s)==ZnO(s)+ Hg(l)的△H为
[? ]
A. +519.4 kJ· mol-1
B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1
D.-519.4 kJ·mol-1
参考答案:C
本题解析:
本题难度:一般
2、选择题 已知2H2(g)+O2(g)═2H2O(l);△H=-569.6kJ?mol-1,2H2O(g)═2H2(g)+O2(g);△H=+482.1kJ?mol-1.现有1g液态H2O,蒸发时吸收的热量是( ?)
A.2.43kJ
B.4.86kJ
C.43.8kJ
D.87.5kJ
参考答案:A
本题解析:
本题难度:简单
3、选择题 在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)═2CO2(g)△H=-566kJ-mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ-mol-1
由1mol?CO(g)和3mol?CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( )
A.2912kJ
B.2953kJ
C.3236kJ
D.3867kJ
参考答案:B
本题解析:
本题难度:简单
4、计算题 某液化石油气由丙烷和丁烷组成,其质量分数分别为80%和20%,它们燃烧的热化学方程式分别为
C3H8(g)+5O2(g)→3CO2(g)+4H2O(g) △H=-2200KJ·mol-1
2C4H10(g)+13O2(g)→8CO2(g)+10H2O(g) △H=-5800KJ·mol-1
有一质量为0.8Kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗该液化石油气0.056Kg。试计算该燃料的利用率[已知水的比热为4.2KJ/(Kg·℃),铝的比热为0.88KJ/(Kg·℃) ]
参考答案:50%
本题解析:
本题难度:一般
5、选择题 在某一容积为2L的密闭容器内,加入0.2 mol CO和0.2 mol H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g) +H2O(g)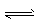 CO2(g) +H2(g) △H=a kJ/mol(a>0)。反应达到平衡后,测得c(CO):c(CO2) =3:2。下列说法中不正确的是
CO2(g) +H2(g) △H=a kJ/mol(a>0)。反应达到平衡后,测得c(CO):c(CO2) =3:2。下列说法中不正确的是
[? ]
A.反应吸收的热量小于0. 2a kJ
B.平衡时H2O的转化率为40%
C.若升高温度,v(正)加快,v(逆)加快,平衡正向移动
D.如下图中曲线I与Ⅱ分别表示其他条件相同时,在1L与2L的密闭容器内 反应过程中CO的物质的量浓度的变化
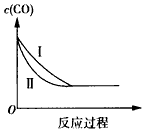
参考答案:D
本题解析:
本题难度:一般