1、选择题 已知450℃时,反应H2(g)+I2(g)  ?2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
?2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  ?H2(g)+I2(g)的化学平衡常 数为
?H2(g)+I2(g)的化学平衡常 数为
A.0.02
B.50
C.100
D.无法确定
2、选择题 反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是
[? ]
A.NO:0.001mol·L-1
B.H2O:0.002mol·L-1
C.NH3:0.002mol·L-1
D.O2:0.00125mol·L-1
3、选择题 下列可逆反应达平衡后,升高温度可使混合气的平均分子量增大的是 (? )
A.N2(g)+3H2(g)  2NH3(g);△H<0
2NH3(g);△H<0
B.H2(g)+I2(g)  2HI(g);△H<0
2HI(g);△H<0
C.2SO3(g)  2SO2(g)+O2(g);△H>0
2SO2(g)+O2(g);△H>0
D.4NH3(g)+5O2(g)  4NO(g)+6H2O(g);△H<0
4NO(g)+6H2O(g);△H<0
4、填空题 已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
| 700
| 800
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
|
回答下列问题:
(1)该反应的平衡常数表达式K=??,△H ?0(填“>”“<”或“=”);
(2)830℃时,向一个5L密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)=? mol·L-1,C的物质的量为??mol;若反应经一段时间后,达到平衡时A的转化率为
??,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ??;
(3)判断该反应是否达到平衡的依据为?(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 ??
A(g)+B(g)的平衡常数的值为 ??
5、填空题 在某密闭容器内有正反应为放热的可逆反应,其中A、B为气体,C为固体,若反应开始经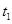 s后达平衡。如图:
s后达平衡。如图:
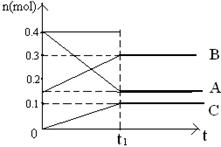
(1)该反应的化学方程式为_________________________
(2)反应物的转化率______________________
(3)要使反应物的转化率增加可能的原因是____________
A.增大了B或C的浓度? B.使用了催化剂
C.缩小体积,使体系压强增大? D.升高了反应温度
(4)该反应达到平衡后,向该容器中再充入0.5mol的He。若恒温恒压,,这时反应速率? _________(填“加快”、“减慢”或“不变”),平衡_____________ (填“向正方向移动”、“向逆方向移动”、“不移动”);若恒温恒容时,这时反应速率_______(填“加快”、“减慢”或“不变”),反应物的转化率___________(填“加快”、“减慢”或“不变”)。