1、选择题 一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷(C2H6)和氧气,其电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O,2H2O+O2+4e-=4OH-,有关此电池的推断不正确的是
[? ]
A.正极发生还原反应
B.正极与负极上参加反应的气体的物质的量之比为2∶9
C.通乙烷的电极为负极
D.电池工作过程中,溶液的pH值逐渐减小
参考答案:B
本题解析:
本题难度:一般
2、计算题 不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示,试根据元素在周期表中的位置,分析图中曲线的变化特点.并回答下列问题。
参考答案:
本题解析:
本题难度:一般
3、简答题 从化工厂铬渣中提取硫酸钠的工艺如下:
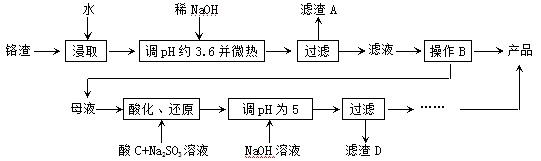
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以?,滤渣A为?(填化学
式)。
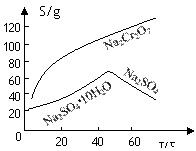
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为?(填
字母序号)
A.蒸发浓缩,趁热过滤? B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
?;酸C为?,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=?。
(4)根据2CrO42-+2H+  ?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的?极,其电极反应式为?。
?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的?极,其电极反应式为?。

参考答案:(1)促进Fe3+水解生成Fe(OH)3而除去;Fe(OH)3
(2)A
(3)3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;H2SO4;1.0×10-32mol/L
(4)正极 ,4OH--4e-=O2+2H2O
本题解析:(1)盐类的水解反应是吸热反应,所以微热能促进Fe3+水解生成Fe(OH)3而除去,A为Fe(OH)3;
(2)根据溶解度曲线,可以看出温度较高时,随着温度的升高,Na2SO4的逐渐减少,所以采用蒸发浓缩,趋热过滤的方法,所以A正确;
(3)酸化后,3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;因为最终产品是Na2SO4,为避免产生杂质,酸C为?酸;恰好完全沉淀时离子深度为c ≤1.0×10-5mol·L-1,Cr3+完全沉淀时pH=5,c(OH-)=1.0×10-9mol·L-1,所以Cr(OH)3的浓度积常数为Ksp=1.0×10-5×1.0×10-9)3=1.0×10-32
(4)根据示意图知,图中右侧Na2CrO4转化为Na2Cr2O7,需要H+,说明右侧电极发生OH-放电,使H2O的电离平衡向右移动,H+增多,所以右侧电极是连接电源的正极,电极方程式为4OH--4e-=O2+2H2O
本题难度:一般
4、选择题 右图为一原电池的结构示意图,下列说法中,错误的是
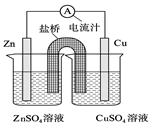
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液
参考答案:D
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的铜离子得到电子,所以选项ABC都是正确的,D不正确,阳离子向正极移动,答案选D。
点评:该题是高考中的常见题型和重要考点,属于中等难度试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力。
本题难度:简单
5、选择题 某原电池装置如图所示。下列有关叙述中,正确的是
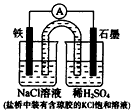
[? ]
A.Fe作正极,发生氧化反应
B.负极反应:2H++2e-=H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.作一段时间后,NaCl溶液中c(Cl-)增大
参考答案:D
本题解析:
本题难度:一般