1、选择题 某一同学根据离子反应方程式2Fe3++Fe====3Fe2+来设计原电池。下列设计方案中可行的是(? )
A.电极材料为铁和锌,电解质溶液为FeCl3溶液
B.电极材料为铁和铜,电解质溶液为Fe(NO3)3溶液
C.电极材料为铁和石墨,电解质溶液为FeCl2溶液
D.电极材料为石墨,电解质溶液为FeCl3溶液
参考答案:B
本题解析:氧化还原反应中的还原剂作原电池的负极,氧化剂(Fe3+)存在于电解质溶液中,故符合题意的选项为B。
本题难度:一般
2、填空题 现有A、B、C、D四种金属片:①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;③把A、C用导线连接后同时浸入稀H2SO4溶液中,电子流动方向为A→导线→C,根据上述情况,回答下列问题:
(1)在①中,金属片______发生氧化反应,金属片______?作正极;
(2)在②中,金属片______作负极;
(3)如果把B、D用导线连接后同时浸入稀H2SO4溶液,则金属片______上有气泡产生;
(4)上述四种金属的活动性由强到弱的顺序是______.
参考答案:(1)把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生,所以A是正极,B是负极,该极上发生氧化反应,故答案为:B;A;
(2)把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应,所以D是正极,C是负极,故答案为:C;
(3)根据①可知金属活泼性顺序为B>A,根据②可知金属活泼性顺序为C>D,根据③可知金属活泼性顺序为A>C,所以金属活泼性顺序是在原电池中,B>A>C>D,如果把B、D用导线连接后同时浸入稀H2SO4溶液,则D为正极,该电极上有气泡产生,故答案为:D;
(4)根据①可知金属活泼性顺序为B>A,根据②可知金属活泼性顺序为C>D,根据③可知金属活泼性顺序为A>C,所以金属活泼性顺序是在原电池中,B>A>C>D,故答案为:B>A>C>D.
本题解析:
本题难度:一般
3、填空题 (9分)根据右图化学电池装置,回答下列问题:
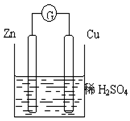
(1)负极发生的反应式为 ,
观察到得现象是 。
(2)正极材料是 ,电极反应为 ,观察到得现象是 。
(3)该装置的能量转化: 。
(4)该装置中电子流向: →电流表→ 。
(5)在下图所示的装置中,能够发生原电池反应的是 。
参考答案:(1) Zn - 2e_ = Zn2+ 锌逐渐溶解
(2) Cu 2H+ + 2e_ = H2↑ 有气泡产生
(3) 化学能转化为电能 (4) Zn Cu (5) B
本题解析:锌比铜活泼,故锌做负极,铜做正极:
(-):Zn - 2e_ = Zn2+ (+):2H+ + 2e_ = H2↑
(5)A中无自发的氧化还原反应,C中乙醇为非电解质,不能构成原电池
本题难度:一般
4、选择题 下列关于原电池的叙述中,正确的是 ( )
A.构成原电池的两极必须是两种不同的金属
B.原电池中发生的反应一定是氧化还原反应
C.原电池工作时总是负极溶解,正极上有物质析出
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原、