1、选择题 控制合适的条件,将反应2Fe3++2?I-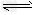 2Fe2++?I2设计成如图所示的原电池。下列判断不正确的是?
2Fe2++?I2设计成如图所示的原电池。下列判断不正确的是?
[? ]
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中加入FeCl2固体,乙中石墨电极为负极
2、填空题 某学校研究性学习小组设计实验探究铝等金属的性质:将一小片久置铝片投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是_______。(填序号) ?
A.?铝与Cl--反应,铝与SO42--不反应 ?
B.?氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强 ?
C.?硫酸铜水解生成硫酸使铝钝化 ?
D.?氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能 ?
E.?生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是_______。
(3)放出的气体是_______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是_______。
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_______。 ?
A.?用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中 ?
B.?把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中 ?
C.?向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片 ?
D.?在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:

其中正确的是______(填序号),由此推知,金属作电极不仅与本身性质相关,而且与______有关。
3、选择题 用吸附了氢气的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是? ( )
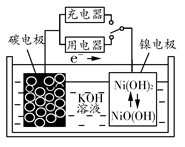
A.放电时,负极的电极反应式为H2-2e-+2OH-=2H2O
B.充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
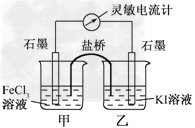
4、选择题 控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下所示的原电池.下列判断不正确的是
2Fe2++I2设计成如下所示的原电池.下列判断不正确的是
[? ]
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
5、选择题 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是

A.电池放电时Na+从b极区移向a极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O