1、选择题 下列离子方程式正确的是( )
A.稀醋酸与氢氧化钾溶液反应H++OH-=H2O
B.铝与稀盐酸反应Al+2H+=Al3++H2↑
C.三氯化铁溶液与氢氧化钠溶液反应Fe3++3OH-=Fe(OH)3↓
D.过量二氧化碳与石灰水反应CO2+2OH-=CO32-+H2O
参考答案:A.醋酸为弱电解质,需要保留分子式,正确的离子方程式为CH3COOH+OH-=H2O+CH3COO-,故A错误;
B.铝与盐酸反应生成氯化铝和氢气,离子方程式必须满足电荷守恒,正确的离子方程式为:2Al+6H+=2Al3++3H2↑,故B错误;
C.三氯化铁溶液与氢氧化钠溶液反应生成氢氧化铁沉淀,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,故C正确;
D.二氧化碳过量,反应产物应该为碳酸氢根离子,正确的离子方程式为:CO2+OH-═HCO3-,故D错误;
故选C.
本题解析:
本题难度:简单
2、填空题 (8分)回答下列有关问题:
(1)硫化铵水解的离子方程式为:S2-+NH4++H2O HS-+ NH3·H2O,
HS-+ NH3·H2O,
如何判断溶液的酸碱性:?。
(2)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:?。有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请你运用所学知识解释:?
?。
(3)用离子方程式解释泡沫灭火器(将硫酸铝与碳酸氢钠溶液混和)灭火原理:?
?。
参考答案:(8分)(1)比较氢硫酸与氨水电离常数的相对大小。
(2)Ksp(HgS)比Ksp(FeS)小。因发生:Hg2++FeS==HgS+Fe2+,产生的Fe2+可氧化为Fe3+,Fe3+水解形成氢氧化铁胶体,吸附杂质而净水。
(3)Al3++3HCO3-==Al(OH)3↓+3CO2↑(每空2分)
本题解析:略
本题难度:简单
3、选择题 下列能正确表示相应过程的离子方程式的是(?)
A.纯碱显碱性的原因:CO32-+ 2 H2O = H2CO3 + 2 OH-
B.稀盐酸和稀氢氧化钠溶液反应的中和热△H=-57.3 kJ/mol,则稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式表示为:
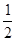 H2SO4(l)+ KOH(l) =
H2SO4(l)+ KOH(l) = 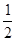 K2SO4 (l)+ H2O(l) △H=-57.3 kJ/mol
K2SO4 (l)+ H2O(l) △H=-57.3 kJ/mol
C.明矾溶液中滴加氢氧化钡溶液至沉淀的物质的量最大:
2 Al3+ +3 SO42-+3 Ba2+ +6 OH- =" 2" Al(OH)3 ↓+ 3 BaSO4 ↓
D.铜和浓硫酸混合加热:2H2SO4(浓)+Cu SO2↑+Cu2+ +SO42-+2 H2O
SO2↑+Cu2+ +SO42-+2 H2O
参考答案:C
本题解析:A、纯碱显碱性的原因:CO32-+ H2O = HCO3- + OH-,错误;B、稀盐酸和稀氢氧化钠溶液反应的中和热△H=-57.3 kJ/mol,则稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式表示为:
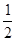 H2SO4(aq)+ KOH(aq) =
H2SO4(aq)+ KOH(aq) = 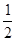 K2SO4 (aq)+ H2O(l) △H=-57.3 kJ/mol,错误;C、正确;D、铜和浓硫酸混合加热,生成的硫酸铜是白色的,原因是水太少,没有电离成离子状态:
K2SO4 (aq)+ H2O(l) △H=-57.3 kJ/mol,错误;C、正确;D、铜和浓硫酸混合加热,生成的硫酸铜是白色的,原因是水太少,没有电离成离子状态:
2H2SO4(浓)+Cu SO2↑+CuSO4+2 H2O。
SO2↑+CuSO4+2 H2O。
本题难度:一般
4、填空题 日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
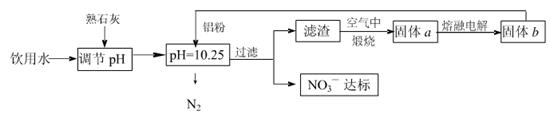
请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成??的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为?。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为?
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为?。
(4)饮用水中的NO3-?主要来自于NH4+。已知在微生物作用下,NH4+?经过两步反应被氧化成NO3-?。两步反应的能量变化示意图如下:
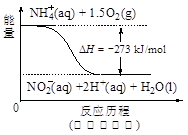 ?
?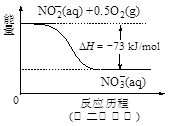
试写出1 mol NH4+?(aq)全部氧化成NO3-?(aq)的热化学方程式是?。
(5)固体a熔融电解时阴极反应式为?
参考答案:(1)铝(或Al)(2分)
(2)①10Al+6NO3—+18H2O=10Al(OH)3↓+3N2↑+6OH—(2分)
②4Al+ 3O2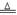 2 Al2 O3? 2Al(OH)3
2 Al2 O3? 2Al(OH)3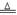 Al2 O3+3 H2O(各2分)
Al2 O3+3 H2O(各2分)
(3)5H2+2NO3—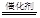 N2↑+4H2O+2OH— (2分)
N2↑+4H2O+2OH— (2分)
(或5H2+2NO3—+2H+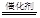 N2↑+6H2O)
N2↑+6H2O)
(4)NH4+?(aq)+2O2(g)=2H+(aq)+NO3-?(aq)+H2O(l)?△H=-346 kJ·mol-1(2分)
(5)Al3++3e-= Al(2分)
本题解析:(1)由于铝能和酸或碱都能反应,该方案在调节pH时,若pH过大或过小都会造成铝(或Al) 的利用率降低。(2)①铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3﹣反应的离子方程式为10Al+6NO3﹣+18H2O=10Al(OH)3+3N2↑+6OH﹣;②滤渣在空气中煅烧过程中涉及的相关反应方程式为4Al+ 3O2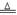 2 Al2 O3和2Al(OH)3
2 Al2 O3和2Al(OH)3 Al2 O3+3 H2O。(3)H2催化还原饮用水中NO3﹣,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3﹣
Al2 O3+3 H2O。(3)H2催化还原饮用水中NO3﹣,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3﹣ N2+4H2O+2OH﹣;(4)由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2﹣ (aq)+H2O(l)△H=﹣2736 kJ?mol﹣1①,第二步热化学反应为NO2﹣ (aq)+0.5O2(g)=NO3﹣ (aq))△H=﹣73kJ?mol﹣1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3﹣ (aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3﹣ (aq)+H2O(l)△H=﹣346 kJ?mol﹣1。(5)固体a熔融电解时阴极是提电子的,反应式为Al3++3e-= Al。
N2+4H2O+2OH﹣;(4)由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2﹣ (aq)+H2O(l)△H=﹣2736 kJ?mol﹣1①,第二步热化学反应为NO2﹣ (aq)+0.5O2(g)=NO3﹣ (aq))△H=﹣73kJ?mol﹣1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3﹣ (aq)的热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+NO3﹣ (aq)+H2O(l)△H=﹣346 kJ?mol﹣1。(5)固体a熔融电解时阴极是提电子的,反应式为Al3++3e-= Al。
本题难度:一般
5、选择题 下列离子方程式书写不正确的是
A.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑
B.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
参考答案:ABC
本题解析:A、电荷不守恒,2Na+2H2O=2Na++2OH-+H2↑
B、质量不守恒,2Al+2OH-+2H2O══ 2AlO2-+3H2↑
C.氨水不能拆开:Al3++ 3NH3·H2O══ Al(OH)3↓+3NH4+。
本题难度:简单