1、填空题 (8分)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 ?2(t-BuNO) 。
?2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K =??。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 ?(填“增大”、“不变”或“减小”)。
(3)实验测得该反应的ΔH =" +" 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是?。

(4)结合ΔS推测该反应的在?(填“较高”或“较低”)温度下有利于该反应自发进行。
参考答案:(8分)(1)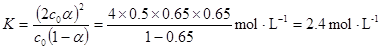
减小?
(3)D(4)较高
本题解析::(1)当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是65%,
则(t-BuNO)2 2(t-BuNO)
2(t-BuNO)
开始 0.5 ?0
转化0.5×65%?0.5×65%×2
平衡0.5×(1-65%)?0.5×65%×2
K= 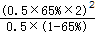 =2.4(mol/L),故答案为:2.4mol/L;
=2.4(mol/L),故答案为:2.4mol/L;
(2)由三段法计算可知,K= 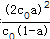 ,温度不变,则K不变,则增大(t-BuNO)2的起始浓度为保证K不变,则转化率a应减小,20℃时该反应在CCl4溶剂中的平衡常数为1.9<2.4,保持(t-BuNO)2起始浓度相同时,由K=
,温度不变,则K不变,则增大(t-BuNO)2的起始浓度为保证K不变,则转化率a应减小,20℃时该反应在CCl4溶剂中的平衡常数为1.9<2.4,保持(t-BuNO)2起始浓度相同时,由K=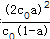 ,则转化率a应小于其在正庚烷溶剂中的平衡转化率,故答案为:减小;小于;
,则转化率a应小于其在正庚烷溶剂中的平衡转化率,故答案为:减小;小于;
(3)由反应的△H=50.5kJ?mol-1,则该反应为吸热反应,则反应物的总能量应小于生成物的总能量,故BC错误;
再由△H=50.5kJ?mol-1,活化能Ea=90.4kJ?mol-1,则反应热的数值大于活化能的数值的一半,故D正确,故答案为:D;
(4)由反应可知,1mol反应物参加反应时生成2mol生成物,则△S>0,再由△H-T△S<0有利于该反应自发进行,
△H>0,则在较高温度下该反应能自发进行,故答案为:>;较高。
点评:本题考查学生利用化学平衡常数及化学平衡的三段法计算来分析解答,考查知识点较集中,注重对学生基础知识和技能的考查,并训练学生分析图象、画图象的能力。
本题难度:一般
2、简答题 发展低碳经济,构建低碳社会.科学家们提出利用以工业废气中的CO2为原料,以CuO与ZnO混合物为催化剂,其反应为:CO2+3H2?CH3OH+H2O.
(1)某温度下,在体积为lL的密闭容器中充入lmolCO2和4molH2,测得CO2和CH3OH(g)的浓度随时间变化如(Ⅰ)图所示.从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=______;氢气的转化率为______.
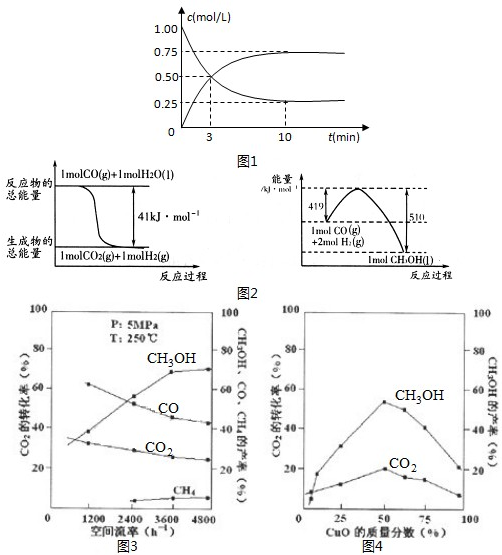
(2)常温常压下已知下列反应的能量变化如(Ⅱ)图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:______,该反应的△S______0(填“>”或“<”或“=”);反应达到平衡后,要使该平衡向右移动,其它条件不变时,可以采取的措施有______(填序号).
A.缩小反应器体积B.升高温度C.恒容条件下通入CO2D.使用合适的催化剂
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO等副产物出现,且CO2的转化率、甲醇和CO的含量还受气体混合物在反应锅炉内的流动速率、催化剂CuO的质量分数影响.通过实验分别得到如图Ⅲ、Ⅳ.
①由图(Ⅲ)得,生产甲醇的气体最佳流动速率为______L?h-1;
②已知当催化剂中没有CuO,只有单组份ZnO时,反应速率最大.说明为什么不选择单组份ZnO的原______,根据图(Ⅳ)判断,催化剂CuO的质量分数最好为______%.
参考答案:(1)10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=0.75mol/L10min0.075mol/L?min;依据化学方程式CO2+3H2?CH3OH+H2O,计算得到反应的氢气物质的量=0.75mol/L×1L×3=2.25mol,氢气转化率=2.25mol4mol×100%=56.25%;
故答案为:0.075mol/(L.min),56.25%;
(2)图2中热化学方程式①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41KJ/mol;
②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)KJ/mol=-91KJ/mol;
依据盖斯定律②-①得到二氧化碳和氢气制备甲醇的热化学方程式:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;反应前后气体体积减小,△S<0,要使该平衡向右移动,其它条件不变时,可以采取的措施依据化学平衡移动原理分析:
A.缩小反应器体积,增大压强,平衡正向进行,故A符合;
B.反应是放热反应,升高温度,平衡逆向进行,故B不符合;
C.恒容条件下通入CO2,增大反应物浓度平衡正向进行,故C符合;
D.使用合适的催化剂改变反应速率不改变化学平衡,故D不符合;
故AC正确;
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol,<,AC;
(3)图象分析生产甲醇的气体最佳流动速率,二氧化碳转化率最大,甲醇产量最大,分析图象数据可知最佳流动速率在3600以上都可以;使用单组份ZnO时反应速率虽然最快,但是由图可知,CO2转化率、CH3OH产率均过低;图象分析,二氧化碳转化率最大,甲醇产量最大时催化剂CuO的质量分数最好是50%;
故答案:3600以上都可以,使用单组份ZnO时反应速率虽然最快,但是由图可知,CO2转化率、CH3OH产率均过低,实际生产中没有意义,故不采用,50%;
本题解析:
本题难度:简单
3、选择题 (6分)(2012?重庆)在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)?2c(g);△H1<0
x(g)+3y(g)?2z(g);△H2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是(?)
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
参考答案:A
本题解析:A、等压时,通入惰性气体,体积增大,对第二个反应平衡向逆反应移动,温度升高,导致第一个反应向逆反应移动;
B、等压时,通入z气体,第二反应平衡向逆反应移动,反应器中温度升高;
C、等容时,通入惰性气体,各反应混合物的浓度不变;
D、等容时,通入z气体,第二反应平衡向逆反应移动.
解:A、等压时,通入惰性气体,气体的体积增大,平衡x(g)+3y(g)?2z(g)(△H>0)向左移动,反应放热,反应体系的温度升高,由于该反应容器是一个不导热的容器,所以平衡a(g)+b(g)?2c(g)也向左(吸热方向)移动,c的物质的量减小,故A错误;
B、等压时,通入z气体,增大了生成物的浓度,平衡x(g)+3y(g)?2z(g)向左移动,由于该反应的逆反应是放热反应,容器内温度升高,虽然导致第一个反应向逆反应移动,但移动结果不会恢复到原温度,故平衡时温度升高,故B正确;
C、等容时,通入惰性气体,各反应物和生成物的物质的量没有变化,即各组分的浓度没有发生变化,所以各组分的反应速率不发生变化,故C正确;
D、等容时,通入z气体,增大了生成物z的浓度,平衡逆向移动,所以y的物质的量浓度增大,故D正确;
故选A.
点评:本题考查外界条件对化学平衡的影响,难度中等,本题要特别注意题干中的信息“不导热的密闭反应器”,注意压强对第一个反应没有影响,根据第二反应的移动热效应,判断第一个反应的移动.
本题难度:一般
4、选择题 温度压强一定,在催化剂铁触媒作用下,向一密闭容器充入N2、H2和NH3。若起始时n(N2)=x mol、n(H2)=y mol、n(NH3)=z mol (x、y、z均不为0 ),平衡时n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是
[? ]
A.N2、H2的转化率不相等
B.平衡时,H2与NH3的生成速率之比为3 : 2
C.x : y =1 : 3
D.x的取值范围为0<x<0.14
参考答案:A
本题解析:
本题难度:一般
5、选择题 已知,I2(aq)+I-(aq) I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是
I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是
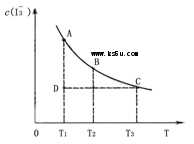
A.反应 I2(aq)+I-(aq)  I3-(aq)的△H>0
I3-(aq)的△H>0
B.状态A的c(I2)比状态D的小
C.A点对应的反应速率大于C点对应的反应速率
D.其他条件不变,向溶液中加入KI固体,平衡由C点移动到D点
参考答案:B
本题解析:
正确答案:B
A、不正确,从图得出,温度升高,I3―浓度变小,平衡逆向移动,△H小于0;
B.正确;
C.不正确,A点对应的反应速率不于C点对应的反应速率,A点温度低;
D.不正确,其他条件不变,向溶液中加入KI固体,不衡正向移动,平衡由C点移动到A点;
本题难度:一般