1、选择题 ?对于工业生产硫酸的反应:SO2(g)+1/2O2(g)? SO3(g);ΔH=-98.3 kJ·mol-1
SO3(g);ΔH=-98.3 kJ·mol-1
下列图象表示正确的是
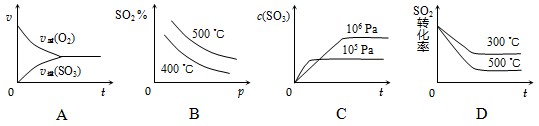 ?
?
参考答案:B
本题解析:平衡时氧气的反应速率和SO2的反应速率是不相等的,A不正确;正反应是体积减小的、放热的可逆反应,所以B正确;压强大,反应速率快,达到平衡的时间短,C不正确;温度高,反应速率快,达到平衡的时间短,D不正确,答案选B。
点评:在分析有关图像时应该注意:
一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?
二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般
2、填空题 在一定温度下,将2mol?A和2mol?B两种气体相混合于体积为2L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g)
xC(g)+2D(g),△H<0,到2min末反应达到平衡状态(温度不变),生成了0.8mol?D,并测得C的浓度为0.4mol?L-1,请填写下列空白:
(1)x的值等于______.
(2)该反应的化学平衡常数K=______,升高温度时K值将______(选填“增大”、“减小”或“不变”).
(3)A物质的转化率为______.
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol?C和3mol?D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为______?mol.
参考答案:(1)平衡时C的浓度为0.4mol/L,故生成C的物质的量为0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,故0.8mol:0.8mol=x:2,解得x=2,
故答案为:2;
(2)平衡时C的浓度为0.4mol/L,则:
? 3A(g)+B(g)?2C(g)+2D(g)
开始(mol/L):1? 1? 0? 0
变化(mol/L):0.6? 0.2? 0.4? 0.4
平衡(mol/L):0.4? 0.8? 0.4? 0.4
故带温度下,该反应的平衡常数k=c2(C)?c2(D)c3(A)?c(B)=0.42×0.420.43×0.8=0.5,
平衡常数只受温度影响,该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小;
故答案为:0.5,减小;
(3)平衡时生成0.8molD,由方程式3A(g)+B(g)?2C(g)+2D(g)可知,参加反应的A的物质的量为0.8mol×32=1.2mol,故A的转化率为1.2mol2mol×100%=60%,
故答案为:60%;
(4)该反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,开始加入C和D各3mol,由化学方程式3A(g)+B(g)?2C(g)+2D(g)可知转化到左边,可以得到A为3mol×32=4.5mol,得到B为3mol×12=1.5mol,故还需要加入B,加入B的物质的量为4.5mol-1.5mol=3mol,
故答案为:B,3mol.
本题解析:
本题难度:简单
3、填空题 ( 6分) 将6 mol X和3 mol Y混合气体置于体积可变的恒压容器中,在一定温度下发生如下反应:2X(g)+Y(g) 2Z(g)。反应达到平衡状态A时,测得气体总物质的量为6.6 mol。,回答下列问题:
2Z(g)。反应达到平衡状态A时,测得气体总物质的量为6.6 mol。,回答下列问题:
(1)达平衡状态A时,Y的转化率为____________,在达到平衡状态A的容器中通入少量Y,体系中X的体积分数____?__(填“增大”或“减小”或“不变”)。
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,若Z的起始物质的量用nz表示,则nz的取值范围是_? ___。
参考答案:( 6分) (1)___80%_________, ___增大__(2)_4.8_<nz_<=6_
本题解析:恒压:
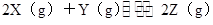
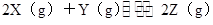
反应前:6mol? 3mol? 0mol
改变量:2a? a? 2a
反应后:6-2a? 3-a? 2a
有6-2a+3-a+2a=6.6mol;a=2.4mol;
得到:
反应前:6mol? 3mol? 0mol
改变量:4.8? 2.4? 4.8
反应后:1.2? 0.6? 4.8
(1)Y的转化率=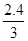 ×100%=80%;因恒压体系,通入y气体,体积变大,平衡逆向移动,体系中X的体积分数增大;
×100%=80%;因恒压体系,通入y气体,体积变大,平衡逆向移动,体系中X的体积分数增大;
(2)K=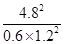 =26.6;Qc=
=26.6;Qc= <K=26.6;4.8<nz<6.
<K=26.6;4.8<nz<6.
本题难度:简单
4、选择题 二氧化硫与氧气的反应为:2SO2(g)+ O2(g) 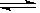 2 SO3 (g); △H <0, 该反应在硫酸工业生产中应采取的适宜条件是(?)
2 SO3 (g); △H <0, 该反应在硫酸工业生产中应采取的适宜条件是(?)
A.低温、高压、催化剂
B.适宜的温度、高压、催化剂
C.低温、常压、催化剂
D.适宜的温度、常压、催化剂
参考答案:D
本题解析:反应2SO2(g)+ O2(g) 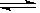 2 SO3 (g); △H <0,为放热反应,且正反应方向为气体体积减少的反应,所以该反应在硫酸工业生产中应采取的适宜条件是适宜的温度、常压、催化剂;
2 SO3 (g); △H <0,为放热反应,且正反应方向为气体体积减少的反应,所以该反应在硫酸工业生产中应采取的适宜条件是适宜的温度、常压、催化剂;
本题难度:一般
5、选择题 右图是恒温下某反应的化学反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是
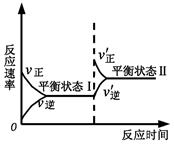
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
D.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
参考答案:D
本题解析:根据图像可以看出平衡状态II的反应速率大于平衡状态I,所以不可能是减小反应物浓度,因此D是错误的。答案选D。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般