1、填空题 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺的流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为____________________________.
(2)流程乙加入烧碱后生成SiO32—的离子方程式为______________________.
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是____________(填化学式),写出该溶液的一种用途____________
(5)已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10—12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________________.
参考答案:(1)Al2O3 + 6H+ = 2Al3+ + 3H2O(3分)
(2)SiO2 +2OH— = SiO32— + H2O(3分)
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)(2分)
(4)NaHCO3(1分);制纯碱或做发酵粉等合理答案(2分)
(5)5.6×10-10mol?L-1(3分)
本题解析:向铝土矿中加入盐酸时,生成Al3+的方程式为Al2O3 + 6H+ = 2Al3+ + 3H2O;加入烧碱时生成SiO32—的离子方程式为SiO2 +2OH— = SiO32— + H2O;Fe3+的检验需加入硫氰化钾或苯酚溶液;向滤液Y和D中通入过量二氧化碳时生成NaHCO3;可做发酵粉或制纯碱;(5)298K时当溶液的pH=13.00时,c(OH-)="0.1mol/L," c(Mg2+)=Ksp/c2(OH)= 5.6×10—12/0.01=5.6×10-10mol?L-1.
本题难度:一般
2、填空题 (8分)某些铁、铝制品的表面常生成一层氧化物,其主要成分分别是氧化铁、氧化铝。请回答:
(1)两种氧化物均能与盐酸反应,生成的两种盐的化学式分别为?、?。向这两种盐的溶液中分别滴加足量氢氧化钠溶液,可观察到:其中一种溶液中的现象是先产生白色沉淀,然后白色沉淀逐渐消失;另一种溶液中的现象是____(填序号)。?
①产生白色沉淀?②产生红褐色沉淀
③产生白色沉淀,迅速变成灰绿色,最后变成红褐色
(2)铝与氧化铁的反应可用于焊接钢轨,其反应的化学方程式为?。
参考答案:(1)FeCl3? AlCl3,?②?(2)2Al + Fe2O3 ?2Fe + Al2O3
?2Fe + Al2O3
本题解析:本题考查铁、铝及其化合物的化学性质及比较,①氧化物:铁的氧化物为碱性氧化物,与酸反应生成盐和水,即Fe2O3+6H+=2Fe3++3H2O,Al2O3为两性氧化物,既能与酸、又能与碱反应,Al2O3+6H+=2Al3++3H2O;②氢氧化物,氢氧化铝为两性氢氧化物,能与碱反应,故有Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO+2H2O,先产生沉淀,后溶解;而在Fe3+里,只产生红褐色的氢氧化铁沉淀;③铝与氧化铁的反应为铝热反应,
2Al+Fe2O32Fe+Al2O3。
本题难度:一般
3、选择题 向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入 2mol/L的NaOH 溶液,所生成沉淀W g 与加入 NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为?(?)
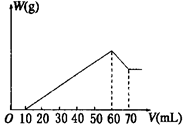 ?
?
A.1:3:1
B.1:2: 1
C.1:1:2
D.1:1 :1
参考答案:D
本题解析:根据图像可知,和盐酸反应的氢氧化钠是10ml,溶解氢氧化铝需要的氢氧化钠是10ml,因此生成氢氧化铝需要的氢氧化钠是30ml,则生成氢氧化镁需要的氢氧化钠是2ml,所以原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为1︰1︰1,答案选D。
本题难度:一般
4、填空题 向一铝制易拉罐中充满CO2后,再往罐中注入足量的质量分数为20%的NaOH溶液立即严封罐口,不一会儿就发现易拉罐变瘪,再过一会易拉罐又鼓胀起来,解释上述实验现象.
(1)易拉罐开始变瘪的原因是:______;反应的化学方程式为:______.
(2)易拉罐又鼓胀起来的原因是:______;其反应的离子方程式为:______.
参考答案:(1)CO2能和氢氧化钠发生反应,CO2被吸收,使罐内气体压强减小而被外界大气压压瘪,反应的化学方程式为:
2NaOH+CO2═Na2CO3+H2O,
故答案为:CO2被吸收,使罐内气体压强减小而被外界大气压压瘪;2NaOH+CO2═Na2CO3+H2O
(2)金属铝能和强碱反应生成氢气,导致罐内气体压强又增大而重新鼓起,金属铝能和强碱反应的实质是:2Al+2OH-+2H2O═2AlO+3H2↑,
故答案为:由于铝与NaOH反应生成H2,气体压强又增大而重新鼓起;2Al+2OH-+2H2O═2AlO+3H2↑;
本题解析:
本题难度:一般
5、简答题 在学习“金属的化学性质”时,我们对铝的性质进行了科学探究.
(1)分别用坩埚钳夹住一小块没有打磨和已经打磨的铝箔,在酒精灯上加热,轻轻晃动,结果观察到的现象是______,这是因为铝表面的氧化膜把熔化的铝“兜着”了.
(2)请你设计实验证明铝能燃烧,方法是______.
(3)能源问题是人们关注的热点,有人提出用金属铝作燃料,这真是一种大胆而新颖的设想.地球上铝资源丰富,如果能用铝作燃料,必将缓解能源紧张的局面.试对铝作为民用新型能源的可能性和现实性发表你的看法:______.
参考答案:1)将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,又因三氧化二铝的熔点高于铝的熔点,铝融化而氧化铝为融化,三氧化二铝在铝的表面,阻止融化的铝与氧气接触,反应不能继续进行,氧化铝膜像一个袋子兜住融化的铝,所以加热铝箔时铝箔熔化,但熔化的铝并不滴落.
故答案为:铝箔熔化,但熔化的铝并不滴落.
(2)三氧化二铝膜,阻止融化的铝与氧气接触,反应不能继续进行,可以把氧化膜戳破,使熔融的铝与氧气接触,让熔化的铝滴在酒精灯火焰上.
故答案为:可以把氧化膜戳破让熔化的铝滴在酒精灯火焰上.
(3)工业上用电解氧化铝的方法制取铝,要消耗大量的电能,不能缓解能源紧张;铝作为民用新型能源,不可行.
故答案为:不可行;工业上用电解氧化铝的方法制取铝,要消耗大量的电能.
本题解析:
本题难度:一般