1、填空题 物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,试回答:
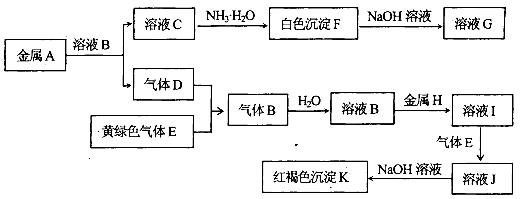
(1)写出下列物质的化学式:气体B是_____________,H是_______________,
(2)写出A与NaOH溶液反应的离子方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:_____________________________________________;
(4)写出反应“F→G”的离子方程式:____________________________________________;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
其反应的原理是(化学方程式)_________________________________________________.
(6)检验溶液J中的金属阳离子,用______________________试剂(填化学式),其现象是
_________________________________.
参考答案:
(1)HCl ,? Fe?
(2)2Al+2OH-+2H2O=2 AlO2-+3H2↑
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)Al(OH)3+OH-=AlO2-+2H2O
(5) 先出现白色沉淀,随即变成灰绿色,最后变成红褐色。
(6) KSCN, 溶液变为血红色,
本题解析:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,气体E是黄绿色气体判断为Cl2,D应为H2,E应为氧化性气体Cl2,B应为HCl,H为Fe,则I为FeCl2,J为FeCl3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,
(1)由以上分析可知B应为HCl? H为Fe?
(2)A与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2 AlO2-+3H2↑
(3)反应“I→J”是FeCl2和Cl2发生反应生成氯化亚铁,反应离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
(4)“F→G”的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
(5)在溶液I中滴入NaOH溶液,可观察到的现象是:先出现白色沉淀,随即变成灰绿色,最后变成红褐色。4Fe(OH)2+O2+2H2O=4Fe(OH)3
(6)检验溶液J中的金属阳离子即Fe3+,可取溶液加入KSCN溶液,溶液变为血红色,证明有Fe3+。
本题难度:一般
2、选择题 下列金属中,遇到盐酸或强碱溶液都能放出氢气的是
A.Cu
B.Mg
C.Fe
D.Al
参考答案:D
本题解析:根据金属的性质进行判断.Al既能与盐酸又能与强碱溶液都能放出氢气。
A、铜与盐酸、强碱溶液不不反应,故A不符合;
B、镁与盐酸反应产生氢气,与强碱不反应,故B不符合;
C、铁与盐酸反应产生氢气.与强碱不反应,故C不符合;
D、铝与盐酸反应生成氯化铝和氢气,与强碱生成偏铝酸盐与氢气,故D符合.
故选D。
点评:本题考查金属的性质、铝的特殊性,难度不大,旨在考查学生对基础知识的掌握,加强基础知识的学习掌握.注意概念既能与酸反应又能与碱反应的物质。
本题难度:一般
3、选择题 镁、铝、铜三种金属粉末的混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过 滤,滤液中存在的离子有
[? ]
A.AlO2-
B.Cu2+
C.Al3+
D.Mg2+
参考答案:A
本题解析:
本题难度:一般
4、选择题 相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比为
A.3:2
B.2:3
C.1:3
D.1:1
参考答案:D
本题解析:由2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,酸、碱均过量,则铝完全反应,铝的物质的量相等,从方程式中可以看到铝与氢气的比例都是2:3,因此产生的氢气是相等的,生成氢气的体积比为1:1,答案选D。
本题难度:一般
5、选择题 工业上制造镁粉是将镁蒸气在气体中冷却。可作为却气体的是(?)
①空气?②CO2?③Ar?④H2?⑤N2
A.①②
B.②③
C.③④
D.④⑤
参考答案:C
本题解析:略
本题难度:简单