1、填空题 如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数

回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为________________.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=______________
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是________
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表?

根据上表数据判断下列说法正确的是________.
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50?mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
参考答案:(1)?Zn2++4OH-==[Zn(OH)4]2-?
(2)10-17
(3)8.0<pH<12.0?
(4)A、B、C、D
本题解析:
本题难度:一般
2、选择题 自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析一定正确的是
[? ]
A.Ksp(PbS)<Ksp(CuS)
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知常温下:KSP(AgCl)=1.8×10-10mol2?L-2,KSP(Ag2CrO4)=1.9×10-12mol3?L-3.则下列叙述正确的是( )
A.AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)<KSP(AgBr)
C.将0.001mol?L-1 AgNO3溶液滴入0.001mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液中,先产生Ag2CrO4沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
参考答案:A.KSP只于温度有关,与溶液中离子浓度无关.故A错误;
B.沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)>KSP(AgBr).故B错误;
C.在AgCl饱和溶液中,Qc(AgCl)=c(Ag+)?c(Cl-)=0.001mol?L-1×0.001mol?L-1=1×10-6mol2?L-2>1.8×10-10mol2?L-2,在Ag2CrO4饱和溶液中,Qc(Ag2CrO4)=c(Ag+)2?c(CrO42-)=0.001mol?L-1×0.001mol?L-1×0.001mol?L-1=1×10-9mol3?L-3>1.9×10-12mol3?L-3,所以均会产生沉淀,但以AgCl沉淀为主在AgCl饱和溶液中,故C错误;
D.银离子与氨水生成氢氧化二氨合银,使平衡向右移动.故D正确.
故选D.
本题解析:
本题难度:一般
4、计算题 (20分)难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s) Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s) 2Ag++
2Ag++ 。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(
。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c( )=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
)=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
(1)Cl-、 谁先沉淀?
谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-的物质的量浓度是多少?(设混合溶液在反应中体积不变)
参考答案:(1)Cl-先沉淀? (2)4.13×10-6 mol·L-1
本题解析:(1)根据两种物质的Ksp,求出生成各自的沉淀所需 的c(Ag+),比较两者c(Ag+),谁需c(Ag+)小谁先沉淀。
沉淀Cl-: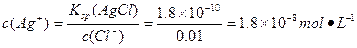 。
。
沉淀 :
: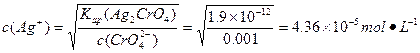 。
。
故先生成AgCl沉淀。
(2)因[c(Ag+)]2·c( )=1.9×10-12,[c(Ag+)]2×0.001 mol·L-1=1.9×10-12,c(Ag+)=4.36×10-5 mol·L-1,c(Ag+)·c(Cl-)=1.8×10-10,4.36×10-5·c(Cl-)=1.8×10-10,c(Cl-)=4.13×10-6 mol·L-1。
)=1.9×10-12,[c(Ag+)]2×0.001 mol·L-1=1.9×10-12,c(Ag+)=4.36×10-5 mol·L-1,c(Ag+)·c(Cl-)=1.8×10-10,4.36×10-5·c(Cl-)=1.8×10-10,c(Cl-)=4.13×10-6 mol·L-1。
本题难度:简单
5、选择题 把固体Ca(OH)2放入蒸馏水中达到溶解平衡后:Ca(OH)2(s)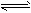 Ca2+ (aq)+2OH-(aq),下列说法中正确的是
Ca2+ (aq)+2OH-(aq),下列说法中正确的是
[? ]
A.给溶液加热,溶液中的Ca2+浓度一定增大
B.恒温条件下向溶液中加入少量CaO,溶液的pH升高
C.向溶液中加入少量CH3COONa晶体,则Ca(OH)2固体的质量增多
D.向溶液中加入少量冰醋酸,溶液中的OH-浓度增大
参考答案:C
本题解析:
本题难度:一般