1、选择题 100℃时,NaCl溶液中c(H+)=1×10-6 mol/L。下列说法中正确的是(? )?
A.该NaCl溶液显酸性
B.该NaCl溶液显碱性
C.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-14
D.该NaCl溶液中KW=c(H+)·c(OH-)=1×10-12
参考答案:D
本题解析:NaCl为强酸强碱盐,其水溶液显示出中性,所以AB错误,根据
KW=c(H+)·c(OH-)=1×10-6×1×10-6=1×10-12,可知答案为D。
点评:该题考查了水的离子积,是高考的重要考点之一,比较容易,但是要注意与之前初中的PH值进行区别,中性溶液的PH并不一定是7,要看具体情况而定。
本题难度:简单
2、填空题 (16分)氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”),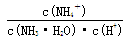 ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时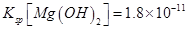 mol3
mol3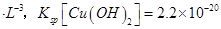 mol3.L-3).
mol3.L-3).
参考答案:Ⅰ. (1)1/2 N2 + 3/2 H2 NH3(2分) (2)正向进行(2分) (3)c(2分)
NH3(2分) (2)正向进行(2分) (3)c(2分)
Ⅱ.(4)增大(1分) 不变 (2分)
(5)NH4++H2O NH3?H2O+H+(2分) 10-5(10-5-10-9)/2a+10-9-10-5 mol·L-1(2分)
NH3?H2O+H+(2分) 10-5(10-5-10-9)/2a+10-9-10-5 mol·L-1(2分)
(6)Cu(OH)2(1分) Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+(2分)
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据平衡常数可知反应的化学方程式为1/2 N2 + 3/2 H2 NH3。
NH3。
(2)在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则产生浓度熵为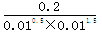 =2000<3000,所以反应向正反应方向进行。
=2000<3000,所以反应向正反应方向进行。
(3)a与b相比,a中含有大量的氨气,因此b中氨气的转化率大于a中。b与d相比,b中氢气浓度大,大转化率高;由于正方应是体积减小的可逆反应,所以增大压强平衡向正反应方向进行,c与b相比,相当于是在b的基础上增大压强,氮气转化率增大,答案选c。
(4)稀释促进氨水的电离,电离程度增大。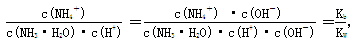 ,因此比值不变。
,因此比值不变。
(5)铵根水解溶液显酸性,方程式为NH4++H2O NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O
NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O NH3?H2O+H+的平衡常数的表达式为
NH3?H2O+H+的平衡常数的表达式为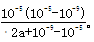 。
。
(6)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+。
考点:考查平衡常数计算与应用、外界条件对电离平衡的影响、盐类水解以及溶度积常数应用等
本题难度:困难
3、简答题 制取纯净的氯化铜晶体(CuCl2?2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2.
II.对I中所得到的溶液按下列步骤进行提纯.
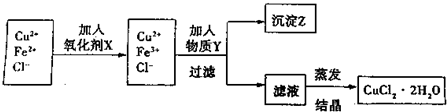
已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH
Fe3+
1.9
3.2
Cu2+
4.7
6.7
|
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是______.(填序号)
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是______.②写出沉淀Z在水中的沉淀溶解平衡方程式:______.
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2?2H2O),应采取的措施是______.
(4)①某同学利用反应:Cu+2H+═Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为______.(填“原电池”或“电解池”)②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液.
(5)已知一些难溶物的浓度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS
Ksp
6.3×10-18
2.5×-13
1.3×10-36
3.4×10-28
6.4×10-53
1.6×10-24
|
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的______除去它们.(选填序号)
①NaOH? ②FeS? ③Na2S.
参考答案:(1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,故答案为:C;
(2)①结合题示,调节pH至4~5,使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2或CuCO3,故答案为:CuO或Cu(OH)2或CuCO3;
②沉淀Z为Fe(OH)3,在溶液中存在溶解平衡:Fe(OH)3(s)?

?Fe2+(aq)+3OH-(aq),故答案为:Fe(OH)3(s)?

?Fe2+(aq)+3OH-(aq);
(3)CuCl2溶液在蒸发结晶过程中发生水解,为抑制其水解,根据Cu2++2H2O

Cu(OH)2+2H+,加入盐酸可起到抑制作用,并且在蒸发过程中要不断搅拌且不能蒸干.
故答案为:在HCl气流下加热浓缩,冷却结晶;
(4)①Cu与盐酸不反应,为使反应Cu+2H+═Cu2++H2↑发生,应设计成电解池,铜作阳极,故答案为:电解池;
②将反应Cu+2H+═Cu2++H2↑设计成电解池,可将铜作阳极,碳棒或铂为阴极,盐酸为电解质,设计电解池为
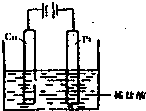
,
故答案为:

;
(5)①加入NaOH,易生成Hg(OH)2,Hg(OH)2不稳定,易分解最终生成有害物质Hg,并且加入NaOH成本较大,过量时引入新的杂质,②FeS较HgS、CuS易溶,加入FeS,可易生成HgS、CuS而除去溶液中的Cu2+、Pb2+、Hg2+,③加入Na2S,过量时易引入S2-杂质,所以只有②符合.
故答案为:②.
本题解析:
本题难度:一般
4、填空题 (15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
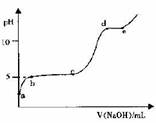
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。
参考答案:(1)  (2)a、c、d (3)CO、CO2
(2)a、c、d (3)CO、CO2
(4)2Al2O3(s)+6C(s)=Al4C3(s)+3CO2 (g) △H="+12" akJ·mol-1
(5)①Al3++3H2O Al(OH)3 +3H+ ②Al(OH)3 ③4×10-28
Al(OH)3 +3H+ ②Al(OH)3 ③4×10-28
本题解析:(1)铝是13号元素,最外层有3个电子,在化学反应中失去3个电子形成铝离子,铝离子的原子结构示意图是
(2) 元素金属性强弱判断依据为看金属与酸或水反应的剧烈程度,反应速率越快,越剧烈,金属性越强,a.分别将Na和Al同时放人冷水中,钠与水剧烈反应,铝几乎不反应,说明钠的金属性强于铝,正确;b.测定等物质的量的Na和A1与酸反应生成H2的体积,与钠、铝失电子数有关,与金属性强弱无关,错误;Al(OH)3能溶于NaOH,说明Al(OH)3是弱碱,NaOH是强碱,所以钠的金属性强于铝,正确;d.用pH计测量NaCl溶液与AlC13溶液的pH,NaCl溶液的PH=7,是强酸强碱盐,AlCl3溶液的PH<7属于强酸弱碱盐,说明Na的金属性强于铝,正确;选a、c、d。
(3)根据化学反应2Al2O3 4Al+3O2,每生产1吨Al,阳极产生8/9吨氧气,若只生成CO,2C + O2 = 2CO大约会损失石墨=(24×8/9)÷32=2/3吨,若只生成CO2 ,C + O2 = CO2,大约会损失石墨=(12×8/9)÷32=1/3吨,实际上损失0.6吨的石墨,所以石墨被氧化为CO和CO2。
4Al+3O2,每生产1吨Al,阳极产生8/9吨氧气,若只生成CO,2C + O2 = 2CO大约会损失石墨=(24×8/9)÷32=2/3吨,若只生成CO2 ,C + O2 = CO2,大约会损失石墨=(12×8/9)÷32=1/3吨,实际上损失0.6吨的石墨,所以石墨被氧化为CO和CO2。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2,化学方程式为2Al2O3+6C=Al4C3+3CO2,转移电子12e-,已知该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为2Al2O3(s)+6C(s)=Al4C3(s)+3CO2 (g) △H="+12" akJ·mol-1。
(5)①a点是硫酸铝溶液,属于强酸弱碱盐,铝离子水解导致溶液呈酸性,用离子方程式表示为Al3++3H2O Al(OH)3 +3H+,
Al(OH)3 +3H+,
②在c→d段pH逐渐增大,说明沉淀逐渐溶解,到达d点,Al(OH)3沉淀已完全溶解,所以c→d时,A1元素的主要存在形式是Al(OH)3。
③向硫酸铝溶液中加入NaOH,当PH=5时开始出现Al(OH)3沉淀,说明此时建立了沉淀溶液平衡,OH-的浓度为10-9mol/L假如,铝离子浓度不变,为0.4mol/L,则A1(OH)3的KSP ≈0.4×[10(-9)]3=4×10-28。
考点:考查铝及其化合物的性质。
本题难度:困难
5、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

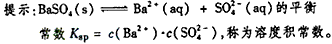
[? ]
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. a点对应的Ksp大于c点对应的Ksp
D. d点无BaSO4沉淀生成
参考答案:D
本题解析:
本题难度:一般