1、填空题 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___?C+?___?KMnO4+?____?H2SO4→____CO2↑+?____MnSO4?+?____K2SO4+?____?
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)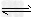 ?CO2(g)+H2(g),得到如下三组数据:
?CO2(g)+H2(g),得到如下三组数据:

①实验1条件下平衡常数K=?____________(取小数二位,下同)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b?的值_____(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正?______________?V逆(填“<”,“>”,“=”)。
(3)最近有科学家提出构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。该构想技术流程如下:?
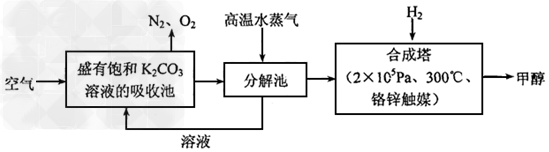
向分解池中通入高温水蒸气的作用是_______________________________
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mo1/L?,则生成沉淀所需CaCl2溶液的最小浓度为__________。
参考答案:(1)5C+4KMnO4+?6H2SO4→5CO2↑+?4MnSO4?+?2K2SO4+?6H2O?
(2)①2.67?②0<a/b<1?③<?
(3)提供高温环境使KHCO3分解
(4)5.6×10-5 mo1/L
本题解析:
本题难度:一般
2、计算题 (10分)Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+K2SO4+2H2O
Ag2O2↓+2KNO3+K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是?
?。
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
?。
(3)准确称取上述制备的样品(设Ag2O2仅含Ag2O)2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下)。计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位)。
参考答案:(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
(2)Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag
(3)0.91
本题解析:(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)。
(2)Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag
(3)n(O2)=224mL/22.4L·mL-1·1000mL· L-1=1.000×10-2 mol
设样品中Ag2O2的物质的量为x, Ag2O的物质的量量为y,则
248g·mol-1 × x + 232 g·mol-1 ×?y =2.588 g
x+1/2 y =1.000×10-2 mol
因此解得x=9.500×10-3 mol、y=1.000×10-3 mol
所以w(Ag2O2)=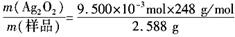 =0.91
=0.91
点评:本题是综合性较强的试题,对学生的要求高。该题难易适中,有利于培养学生规范的实验操作能力,以及规范答题能力。需要学生通过认真的审题、思考,找出问题的关键点,也不难得出正确的结论。
本题难度:一般
3、选择题 溶度积常数表达式符合Ksp=·c(By-)的是( )
A.AgCl(s) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B.Na2S 2Na++S2-
2Na++S2-
C.Ag2S(s) 2Ag+(aq)+S2-(aq)
2Ag+(aq)+S2-(aq)
D.PbI2(s) Pb2+(aq)+2I-(aq)
Pb2+(aq)+2I-(aq)
参考答案:C
本题解析:由于Ksp=[c(Ax+)]2·c(By-),即阳离子前的系数为2;Na2S为可溶性盐不存在溶度积常数,故C正确。
本题难度:一般
4、选择题
FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp==1.3×l0-36 mol2·L-2。
下列说法正确的是(?)
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
参考答案:D
本题解析:FeS与CuS的化学式形式相同,可以直接通过溶度积常数比较二者的溶解度,Ksp越小,溶解度越小,A错;溶度积常数与物质的本性和温度有关,B错;物质的溶度积越小,越容易沉淀,B错;FeS的溶度积大于CuS的溶度积,其溶解平衡的S2-浓度远大于CuS的S2-离子浓度,故加入FeS可以沉淀废水中的Cu2+,D对。
本题难度:简单
5、简答题 在进行胃部透视时,为取得良好的检查效果,需要在检查之前服用“钡餐”,“钡餐”的主要成分是硫酸钡.在25℃时,1L水中约能溶解2.4×10-3g?硫酸钡,它的溶度积常数Ksp=1.1×10-10.
(1)钡离子是一种有毒的重金属离子,当人体中钡离子浓度达到2×10-3mol?L-1时,就会对健康产生危害.请通过计算说明为什么可以用硫酸钡作为“钡餐”.
(2)在25℃时,1L水中约能溶解0.018g?碳酸钡,且胃液是酸性的,能否用碳酸钡代替硫酸钡作为“钡餐”的主要成分?
参考答案:(1)根据硫酸钡的溶解平衡计算,在硫酸钡中存在平衡:BaSO4(s)

?Ba2+(aq)+SO42-(aq),
c(Ba2+)=
本题解析:
本题难度:一般