1、填空题 补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol?L-1、0.008mol?L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理
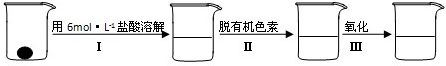
③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10mL
④比色,直到与选取的标准颜色一致或相近即可.
试回答下列问题:
(1)配制25mL0.01mol?L-1标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:______,若配制过程中定容时俯视刻度会使配制的浓度______(填偏大、偏小、不影响).
(2)步骤②脱色过程包括加入:______(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→______(填操作).
(3)比色法确定待测液的浓度的原理是______
(4)已知有关离子的还原性顺序为I->Fe2+>SCN->Br->Cl-,则步骤②中Ⅲ可选择的氧化剂有______a.碘水?b.溴水?c.氯水?d.通入(SCN)2;写出加入上述某一氧化剂时涉及到的离子反应方程式:______
(5)若其补铁剂是由乳酸
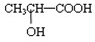
?与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:______.
参考答案:(1)反应操作步骤有量取、溶解、移液、洗涤、定容、摇匀等操作,首先用量筒量量取一定体积的溶液在烧杯中溶解,冷却后转移到25ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加;定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏大,
故答案为:25mL容量瓶、胶头滴管;偏大;
(2)活性炭具有吸附性,可用来脱色,具有漂白性,脱色后,活性炭不溶于水,可用过滤的方法分离,故答案为:活性炭;过滤;
(3)溶液浓度越大,颜色越深,故答案为:溶液颜色与物质的量浓度成正比;
(4)由于离子的还原性顺序为I->Fe2+>SCN->Br->Cl-,所以溴水、氯水能将亚铁离子氧化为铁离子.加入氯水反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:bc;Cl2+2Fe2+=2Fe3++2Cl-;
(5)该补铁剂为乳酸亚铁[CH3CH(OH)COO]2Fe,乳酸具有弱酸性,利用强酸制弱酸.所以盐酸与乳酸亚铁[CH3CH(OH)COO]2Fe生成乳酸和氯化亚铁,反应方程式为[CH3CH(OH)COO]2Fe+2HCl→2CH3CH(OH)COOH+FeCl2,故答案为:[CH3CH(OH)COO]2Fe+2HCl→2CH3CH(OH)COOH+FeCl2.
本题解析:
本题难度:一般
2、选择题 实验室里需用480?mL?0.1?mol/L的硫酸铜溶液,现选用500?mL容量瓶进行配制,以下操作正确的是
[? ]
A.称取7.68?g硫酸铜,加入500?mL水
B.称取12.0?g胆矾,配成500?mL溶液
C.称取8.0?g硫酸铜,加入500?mL水
D.称取12.5?g胆矾,配成500?mL溶液
参考答案:D
本题解析:
本题难度:简单
3、实验题 氯化钠溶液在生产、生活中都有广泛的用途。现配置1?L?0.2?mol·L-1?NaCl溶液。请回答问题。
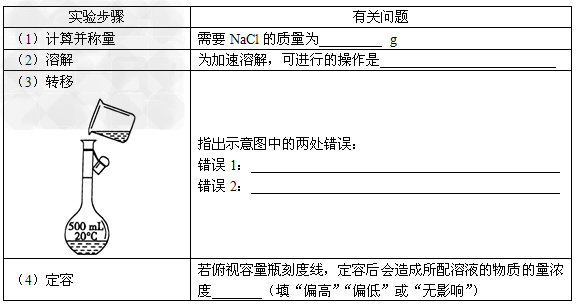
参考答案:(1)11.7?
(2)用玻璃棒搅拌?
(3)向容量瓶中转移溶液时未用玻璃棒引流;容量瓶容积与所配溶液体积不匹配?
(4)偏高
本题解析:
本题难度:一般
4、选择题 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因可能是( )
A.所用固体NaOH已潮解
B.定容时仰视刻度
C.用带游码的托盘天平称2.4gNaOH时,误把砝码放在了左边
D.配制完毕,不小心溅出几滴溶液,为使溶液的浓度不减少,又在配好的溶液中加入少量的NaOH固体
参考答案:D
本题解析:
本题难度:简单
5、简答题 在标准状况下,将224L?HCl气体溶于635mL水(ρ=1.00g?cm-3)中,所得盐酸的密度为1.18g?cm-3.此溶液物质的量浓度应该为多少?若取出这种盐酸10.0mL,向其中加水配制成1L溶液,则所得稀盐酸的物质的量浓度应该为多少?
参考答案:标准状况下,将224L?HCl气体的物质的量为224L22.4L/mol=10mol,故HCl的质量为10mol×36.5g/mol=365g,
635mL水的质量为635mL×1g/mL=635g,故HCl的质量分数为365g365g+635g×100%=36.5%,故所得盐酸的物质的量浓度为1000×1.18×36.5%36.5mol/L=11.8mol/L,
根据稀释定律,稀释前后溶质HCl的物质的量不变,令稀释后稀盐酸的浓度为c,则:
11.8mol/L×0.01L=c×1L
解得c=0.118mol/L,
答:所得盐酸的物质的量浓度为11.8mol/L,稀释后所得稀盐酸的物质的量浓度0.118mol/L.
本题解析:
本题难度:一般