1、简答题 今欲用NaOH固体配制480mL0.2mol/L的NaOH溶液.
(1)配制过程中应当使用______mL的容量瓶.使用容量瓶之前必须要检查______.
(2)需要称量______g的NaOH固体.
(3)在配制过程中,下列操作将导致实际所配溶液浓度偏低的是______(填序号)
①称量后的NaOH固体在空气中露置的时间过长;
②溶解NaOH后未经冷却至室温就转移到容量瓶中;
③转移溶液后未洗涤烧杯和玻璃棒就直接定容;
④在容量瓶中进行定容时俯视刻度线.
2、简答题 实验室制配0.5mol/L的NaOH溶液500mL,有以下仪器:①烧杯?②100mL量筒③1000mL容量瓶?④500mL容量瓶?⑤玻璃棒?⑥试管?⑦药匙
(1)配制时,必须使用的仪器有______(填代号)还缺少的仪器是______.
(2)实验两次用到玻璃棒,其作用分别是:______、______.
(3)配制时,一般可分为以下几个步骤:①称量?②计算?③溶解?④摇匀⑤转移⑥洗涤?⑦定容?⑧冷却.其正确的操作顺序为______.
(4)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______.
②某同学观察液面的情况如图所示,则所配置的溶液的浓度______.
(5)取出其中50ml溶液加水稀释到100ml,稀释后溶液中NaOH的物质的量浓度为______.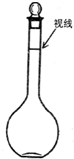
3、简答题 (1)在MgCl2、NaCl、Na2SO4三种盐的混合溶液1L,若Na+为3mol、Cl-为3.8mol、Mg2+为1.5mol,则Na2SO4的物质的量浓度为______mol/L.
(2)在标准状况下,100ml某气体X的质量是0.179克,则这种气体X的相对分子质量是______.
(3)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液.则在Cl2、Cl-、H+中,氧化性最强的是______.
(4)有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;③Z单质溶于X2Y中,所得溶液具有漂白作用;④Z单质可以与石灰乳反应制漂白粉.
①写出元素Z的名称:______.②写出④的化学反应方程式为:______.
4、选择题 在无土栽培中,需配制一定量含50mol NH4Cl、16mol KCl和24mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
[? ]
A.2、64、24
B.64、2、24
C.32、50、12
D.16、50、24
5、选择题 下列配制的溶液浓度偏高的是( )
A.配制稀盐酸用量筒量取浓盐酸时,俯视刻度线
B.用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒2-3次,洗液倒入烧杯中
C.称量11.7gNaCl配制0.2mol/LNaCl溶液时,砝码错放在左盘
D.定容时仰视刻度线