1、实验题 高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。

相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
物质
| SiCl4
| BCl3
| AlCl3
| FeCl3
| PCl5
|
沸点/℃
| 57.7
| 12.8
| —
| 315
| —
|
熔点/℃
| -70.0
| -107.2
| —
| —
| —
|
升华温度/℃
| —
| —
| 180
| 300
| 162
|
?
请回答下列问题:
(1)仪器e的名称为____________,装置A中f管的作用是_______________________________________,其中发生反应的离子方程式为_____? ____________________________________?_______。
(2)装置B中的试剂是____________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
?
(4)在上述(3)的评价基础上,请设计一个合理方案:___________?________?。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是?(填写元素符号)。
参考答案:(1)蒸馏(具支)烧瓶(1分);平衡压强,使液体从分液漏斗中顺利流下(2分)
MnO2+4H++2Cl- Mn2++2H2O+Cl2↑(2分)
Mn2++2H2O+Cl2↑(2分)
(2)饱和食盐水(1分)
(3)
方案
不足之处
甲
①空气中的水蒸气进入产品收集装置,使产品水解;②没有尾气处理,氯气
会污染空气(2分)
乙
①收集产品的导管太短,易堵塞;②没有冷凝装置,产品易损失(2分)
?
(4)在装置I的i处连接干燥管j(2分)
(5)Al、P、Cl(3分)
本题解析:(1)根据仪器的结构可知,仪器e是蒸馏(具支)烧瓶。f管是将分液漏斗与烧瓶相连,则它们中的压强是相等的,这样便于分液漏斗中的盐酸能顺利滴下。装置A是制备氯气的,实验室用浓盐酸与二氧化锰在加热的条件下制备,因此该反应的离子方程式为MnO2+4H++2Cl- Mn2++2H2O+Cl2↑。
Mn2++2H2O+Cl2↑。
(2)由于浓盐酸易挥发,因此生成的氯气中含有氯化氢,对后续的实验造成干扰,需要除去氯化氢,因此装置B中的试剂是饱和食盐水,用来除去氯气中的氯化氢气体。
(3)SiCl4的沸点很低,只有57.7℃,而反应的温度达几百度,故需要冷凝收集。又因为四氯化硅极易水解,而甲方案中g接装置Ⅰ,h与空气直接相连,则空气中的水蒸气进入产品收集装置,使产品水解;另外氯气有毒,需要尾气处理,而甲方案中没有尾气处理,氯气会污染空气;在乙方案中g接装置Ⅱ,由于四氯化硅冷凝后变为固体,易堵塞导管口。另外没有冷凝装置,产品易损失。
(4)由于四氯化硅易水解,因此需要有干燥装置,所以在方案甲的基础上在装置I的i处连接干燥管j即可。
(5)从物质的物理性质表可发现,AlCl3、FeCl3和PCl5均易升华,故精馏后的残留物中,除铁元素外可能还含有的杂质元素是还应还有Al、P、Cl元素。
本题难度:一般
2、选择题 制造普通铅笔蕊的物质是
[? ]
A.铅
B.铅粉和石墨粉的混合物
C.石墨粉
D.石墨粉和粘土粉的混合物
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列离子方程式书写不正确的是(?)
A.大理石跟盐酸反应:CaCO3+2H+====Ca2++H2O+CO2↑
B.石灰水中通入CO2:CO2+Ca2++2OH-====CaCO3↓+H2O
C.在水玻璃(Na2SiO3)溶液中加入盐酸:Na2SiO3+2H+====H2SiO3↓+2Na+
D.二氧化硅与烧碱溶液反应:SiO2+2OH-====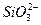 +H2O
+H2O
参考答案:C
本题解析:离子方程式书写遵循凡是溶于水的强电解质均写离子形式,其他应写化学式的规则。
本题难度:简单
4、选择题
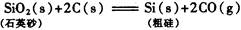 ?
?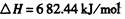
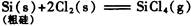 ?
?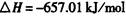
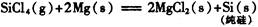 ?
?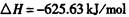
生产1.00kg纯硅的总反应热为:(?)
A.2.43 × 104 kJ
B.—2.35 × 104 kJ
C.—2.23 × 104 kJ
D.—2.14× 104 kJ
参考答案:D
本题解析:据盖斯定律可知,生产1mol纯硅的反应热为:
△Η=682.44-657.01-625.63= -600.2KJ/mol,所以生产
1.00kg纯硅的总反应热=-600.2KJ/mol×1000g/28g/mol= —2.14× 104 kJ,所以 选D
本题难度:一般
5、选择题 在150℃时碳酸铵可以受热完全分解,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍?(?)
A.96倍
B.48倍
C.12倍
D.32倍
参考答案:C
本题解析:略
本题难度:简单