1、计算题
(1)石灰石样品中SiO2的质量分数。
(2)中和多余盐酸所需1mol/L NaOH溶液的体积。
2、选择题 A、B、C为短周期中相邻三元素,A、B同周期,B、C同主族。已知此三元素原子的最外层电子数之和为13,而其质子数之和为27,则此A、B、C三元素为(? )
A.P、Si、C? B.N、C、Si? C.B、C、Si? D.Al、Si、C
3、选择题 2001年报道硼和镁形成的化合物刷新了金属化合物最高温度的记录。右示意图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子;6个硼原子位于棱柱内(未画出)。则该化合物的化学式可表示为?(?)
A.MgB
B.MgB2
C.Mg2B
D.Mg3B2
4、填空题 已知A、B、C、D、E、F、G、H可以发生如图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。

请完成以下填空:
(1)H的名称是________。
(2)E的两种用途是________、________。
(3)反应③的化学方程式是________。
(4)反应④的离子方程式是________。
5、填空题 硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:?
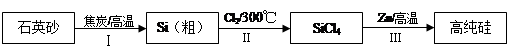
(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是?。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是?。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是?。
(4)Zn还原SiCl4的反应如下:
反应1:?400℃~756℃ ,SiCl4(g) + 2Zn(l)  ?Si(s) + 2ZnCl2(l)? ΔH1 <0?
?Si(s) + 2ZnCl2(l)? ΔH1 <0?
反应2:? 756℃~907℃ ,SiCl4(g) + 2Zn(l)  ?Si(s) + 2ZnCl2(g)? ΔH2 <0?
?Si(s) + 2ZnCl2(g)? ΔH2 <0?
反应3: ?907℃~1410℃,SiCl4(g) + 2Zn(g)  ?Si(s) + 2ZnCl2(g)? ΔH3 <0?
?Si(s) + 2ZnCl2(g)? ΔH3 <0?
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率? b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率? d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是?。
③ 已知Zn(l)=Zn(g)? ΔH =" +116" KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程?。