1、简答题 恒温下,将16molN2与bmolH2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若反应进行到某时刻t时,nt(H2)=15mol,nt(NH3)=6mol,则b的值为______.
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时:
①原混合气体与平衡混合气体的总物质的量之比______(写出最简整数比,下同)
②达到平衡时,N2和H2的转化率之比a(N2):a(H2)______
③平衡混合气体中,n(N2):n(H2):n(NH3)______.
参考答案:(1)根据方程式计算:
N2(g)+3H2(g)?2NH3(g)
起始(mol):16molb 0
转化(mol):3mol9mol 6mol
t时刻(mol):15mol6mol
所以b-9=15,则b=24,
故答案为:24;
(2)反应达平衡时,混合气体为716.8L22.4L/mol=32mol,其中NH3的物质的量为32mol×25%=8mol,
①利用差量法计算:
N2 (g)+3H2(g)?2NH3(g),物质的量减少△n
1mol 3mol 2mol 2mol
转化:4mol 12mol 8mol 8mol
故原混合气体为:32mol+8mol=40mol,
则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=40mol:32mol=5:4,
答:原混合气体与平衡混合气体的总物质的量之比为5:4;
②反应转化的氮气物质的量为4mol,转化率为:4mol16mol×100%=25%,
转化的氢气物质的量为12mol,转化率为:12mol24mol×100%=50%,
达到平衡时,N2和H2的转化率之比a(N2):a(H2)=25%:50%=1:2,
答:达到平衡时,N2和H2的转化率之比a(N2):a(H2)为1:2;
③平衡混合气的组成为:N2为16mol-4mol=12 mol,NH3为8 mol,H2为32mol-12mol-8mol=12mol,
平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,
答:平衡混合气体中,n(N2):n(H2):n(NH3)为3:3:2.
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.H2S的水溶液中,c(H+)与c(S2—) 之比为2:1
B.( NH4)2SO4溶液中c(NH4+)与c(SO42—) 之比为2:1
C.一定温度下,将SO3 (g)放入密闭容器中反应达到平衡后,n(SO2)与n(O2) 比为2:1
D.相同温度下,1mol/L的醋酸溶液与0.5mol/L醋酸溶液中c(H+)之比为2:1
参考答案:C
本题解析:A. H2S的水溶液中,所含的离子是H+、S2—、HS—、OH— ,c(H+)=2c(S2—)+ c(HS—) + c(OH—) ,根据上式可推知c(H+)与c(S2—) 之比大于2:1;
B. ( NH4)2SO4溶液中,由于NH4+水解,c(NH4+)与c(SO42—) 之比小于2:1;
C. 一定温度下,将SO3 (g)放入密闭容器中反应为2SO3 2SO2+O2,根据反应方程式生成的n(SO2)与n(O2) 比为2:1,C正确;
2SO2+O2,根据反应方程式生成的n(SO2)与n(O2) 比为2:1,C正确;
D. 醋酸是弱酸,浓度越小电离度越大,相同温度下,1mol/L的醋酸溶液与0.5mol/L醋酸溶液中c(H+)之比小于2:1;D错误。
本题难度:一般
3、填空题 (1)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)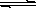 Cu2+(aq)+2OH-(aq),常温下其Ksp=
Cu2+(aq)+2OH-(aq),常温下其Ksp=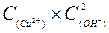 =
=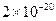 ?。
?。
①某硫酸铜溶液里Cu2+浓度0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
②要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液,使溶液中OH-浓度为 。
(2)用标准的NaOH滴定未知浓度的盐酸,盐酸装在锥形瓶中,并滴入酚酞为指示剂,NaOH溶液装在?(填仪器名称)中。造成测定结果偏高的原因可能是?。
A.未用标准液润洗,就装入标准液
B.滴定前读数时仰视,滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用待测液润洗
D.滴定过程中,锥形瓶中有数滴溶液溅出