1、选择题 利用下列各组中的物质制备并收集少量相应的气体,能采用如图装置的是
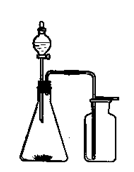
①浓氨水和固体NaOH制NH3?②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2?⑥电石和水制C2H2
⑦锌粒和稀硫酸制H2?⑧乙醇和浓硫酸制C2H4A.②③? B.①⑥⑦?C.②⑤⑧?D.①④⑥
2、选择题 制取下列元素的单质时,反应原理相同的是
A.Cl、Br、P
B.Mg、Al、Cu
C.Fe、Sn、Br
D.Si、P、Cl
3、实验题 (12分)Na2S2O3(俗称保险粉)在医药、印染中应用广泛,可通过下列方法制备:取15.1 gNa2SO3溶于80.0 mL水。另取5.0 g硫粉,用少许乙醇润湿后加到上述溶液中。小火加热至微沸,反应1小时后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O。
(1)加入的硫粉用乙醇润湿的目的是?。
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机化合物杂质是?;其检测的方法是:取出少许溶液,加盐酸至酸性后,过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:
Na2SO3+2HCl=SO2↑+H2O+2NaCl;?。
(3)某环境监测小组用含0.100 mol·L-1Na2S2O3溶液[含少量的Na2SO3,且n(Na2S2O3) ∶n(Na2SO3)
= 5∶1]测定某工厂废水中Ba2+的浓度。他们取废水50.0 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀硫酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,用上述Na2S2O3溶液进行滴定,反应完全时,测得消耗Na2S2O3溶液的体积为36.0 mL。
(已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+?2Cr3++3I2+7H2O;
②I2+2S2O32-?2I-+S4O62-;③I2+SO32-+H2O?2I-+SO42-+2H+)
则滴定过程中可用?作指示剂。计算该工厂废水中Ba2+的物质的量浓度。
4、选择题 下列气体中既不能用浓硫酸干燥,又不能用固体NaOH干燥的是(?)
A.CO2
B.O2
C.SO2
D.H2S
5、选择题 可以用下图所示装置收集并干燥的气体是
 ?
?
A.H2
B.NH3
C.Cl2
D.SO2