1、填空题 阅读下表中部分短周期主族元素的相关信息:

请回答:
(1)元素T与X按原子个数比1:1形成的化合物B所含的化学键有____________ (填化学键名称)。已知在通常条件下,39g B与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式 ____________。
(2)写出Y元素最高价氧化物对应水化物的电离方程式:__________________ 。将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式______________ 、______________ 。
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移2 mol电子,写出该反应的离子方程式________________ 。
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式____________________ 。
参考答案:(1)离子键、非极性共价键?;
2Na2O2(s)+ 2CO2(g) = 2Na2CO3(s)+ O2(g);△H=-4Q kJ/mol?
(2)H++AlO2-+H2O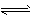 Al(OH)3
Al(OH)3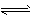 Al3++3OH-? ?;Al3++4OH-= AlO2-+2H2O ;
Al3++3OH-? ?;Al3++4OH-= AlO2-+2H2O ;
Al3+ + 3AlO2-+ 6H2O= 4Al(OH)3↓?
(3)SO32- + ClO- = SO42- + Cl-?
(4)O2 + 4e- + 2H2O = 4OH-
本题解析:
本题难度:一般
2、选择题 下列电池工作时能量转化形式与其它三个不同的是

参考答案:B
本题解析:A、原电池把化学能转化为电能;B、把太阳能转化为电能;C、化学能转化为电能;D、化学能转化为电能,因此答案选B。
考点:考查能量转化的判断
本题难度:一般
3、选择题 如图甲和乙是双液原电池装置.由图可判断下列说法错误的是( )
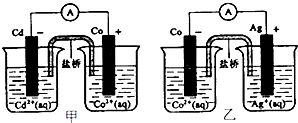
A.甲图电池反应的离子方程式为Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
B.2?Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)反应能够发生
C.盐挢的作用是形成闭合回路,并使两边溶液保持电中性
D.乙图当有lmol电子通过外电路时,正极有108克Ag析出
参考答案:A.根据图片知,Cd失电子,Co2+得电子,所以其电池反应离子方程式为:Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq),故A正确;
B.根据图片知,Cd失电子,Ag+得电子,所以2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)反应不能发生,故B错误;
C.原电池放电时,盐桥中的阴阳离子定向移动而构成闭合回路,且使两溶液中电荷相等,所以盐桥的作用是形成闭合回路,并使两边溶液保持电中性,故C正确;
D.根据Cd(s)+2Ag+(aq)=2Ag(s)+Cd2+(aq)知,当有lmol电子通过外电路时,正极有108克Ag析出,故D正确;
故选B.
本题解析:
本题难度:简单
4、选择题 某CH4燃料电池,工作环境是熔融的金属氧化物(MO),它能传导O2-,有关CH4燃料电池的说法中正确的是
A.电池内部电子从正极流向负极
B.负极电极反应式为:CH4-8e- + 10OH-=CO32-+ 7H2O
C.正极电极反应式为:O2 + 4e-=2O2-
D.每消耗22.4 L CH4,外线路中将通过8 mol电子
参考答案:C
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,所以A不正确;B不正确,由于是熔融的盐作为电解质,则负极电极反应式是CH4-8e- +4O2-=CO2+ 2H2O;氧气在正极得到电子,生成氧离子,C正确;选项D中不能确定甲烷的状态,则22.4L甲烷不一定是1mol,D不正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,旨在培养学生分析、归纳和总结问题的能力,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。另外该题还要注意电解质是熔融盐,而不是水溶液。
本题难度:一般
5、选择题 把金属A和金属C分别投入到等浓度的盐酸中,A比C反应剧烈;A与金属B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为
A.A>C>B B.A>B>C C.B>A>C D.B>C>A
参考答案:C
本题解析:金属越活泼,越容易和盐酸反应,反应就越剧烈,所以A的金属性强于C的;原电池中较活泼的金属是负极,失去电子,发生氧化反应,所以根据A与金属B组成原电池时,A为电池的正极可知,金属性是B大于A,则A、B、C三种金属的活动性顺序为B>A>C,答案选C。
考点:考查元素金属性强弱的判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中。在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和训练。该题的关键是明确金属性强弱比较的规律,特别是利用原电池原理比较金属性强弱的规律,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单