1、填空题 (10分)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色沉淀,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为__________________________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
参考答案:本题共10分
(1)Pb(1分); 氧化(1分)
(2)减小(1分); 负(1分)
(3)PbO2+2 e-+SO2-4+4H+=PbSO4+2H2O(2分)
(4)H2-2e-+2OH-=2H2O(2分); 5.6(2分)
本题解析:(1)该蓄电池的负极发生氧化反应,根据总化学反应方程式可知,Pb作负极,放电时发生氧化反应;
(2)放电时消耗硫酸,生成硫酸铅和水,所以电解质溶液的酸性减小,放电相当于是原电池,所以电解质溶液中的阴离子移向负极;
(3)放电时的正极即是PbO2发生还原反应,得电子与硫酸结合生成硫酸铅,电极反应式为
PbO2+2 e-+SO2-4+4H+=PbSO4+2H2O;
(4)氢氧燃料电池中的电解质溶液若为KOH溶液,则在负极发生氧化反应的氢气,失去电子,与氢氧根离子结合生成水,电极反应式为H2-2e-+2OH-=2H2O,该电池工作时,正极的反应式为O2+4e-+2H2O=4OH-,所以外电路每流过1×103 mol e-,则消耗氧气得物质的量是1000/4=250mol,标准状况下的体积是250mol×22.4L/mol=5600L,合5.6m3。
考点:考查电化学反应原理的应用,电极反应式的书写,氧化还原反应的计算
本题难度:一般
2、填空题 海水中蕴藏着丰富的资源.海水综合利用的流程图如图1.
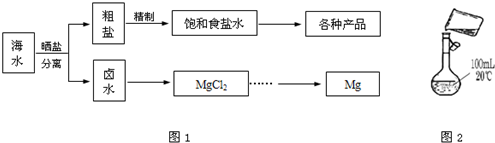
(1)为检验精盐纯度,需配制250mL?0.2mol/L?NaCl(精盐)溶液,图2是该同学转移溶液的示意图,图中有两点错误请指出:______
(2)用NaCl做原料可以得到多种产品.
实验室用惰性电极电解100mL?0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况,假设气体物质全部从溶液中逸出),则所得溶液的pH为______(忽略反应前后溶液的体积变化).
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图3所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①图中X、Y分别是______、______(填化学式),②写出燃料电池B中正极发生的电极反应______;
(4)图4欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).
参考答案:(1)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制250mL的溶液要采用250mL的容量瓶,故答案为:未用玻璃棒引流;未采用250?mL容量瓶;
(2)因电解饱和食盐水的方程式:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,当产生的H2的体积为112mL即0.005mol时,生成氢氧化钠的物质的量为0.01mol,所以溶液中NaOH的物质的量浓度=0.01mol0.1L═0.1mol/L,所以氢离子的浓度为1×10?-140.1=1×10-13mol/L,PH=13,故答案为:13;
(3)①电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程,阴极是氢离子得电子生成氢气的过程,故答案为:Cl2,H2;
②氢氧燃料电池的电解质是碱时,电池总反应式均可表示为:2H2+O2=2H2O,其正极反应表示为:O2+2H2O+4e-=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(4)Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即:
,故答案为:
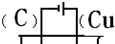
.
本题解析:
本题难度:一般
3、选择题 某研究小组设计了如图所示的循环系统,来生产能解决能源危机的某种物质,其中所需的电能由太阳能光电池提供.有关叙述正确的是( ? )
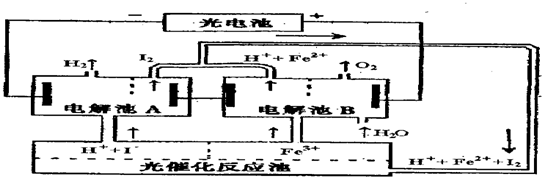
A.设计该循环系统的目的是制取I2
B.电解池A中离子反应方程式:H2+I2 2H++2I-
2H++2I-
C.光催化反应池中离子反应方程式为:2Fe2++I2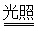 2Fe3++2I-
2Fe3++2I-
D.该系统中的Fe3+、H2O、I-都是循环使用的物质
参考答案:C
本题解析:
本题难度:简单
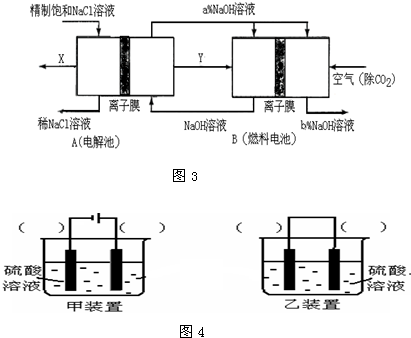
4、填空题 (1)图1装置发生反应的离子方程式为 。
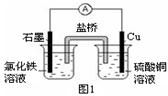
(2)图2装置中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。

① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
(3)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 b处的电极反应式 ,
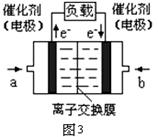
甲醇燃料电池的总反应化学方程式 。
参考答案:(14分)
(1)2Fe3+ + Cu = 2Fe2+ + Cu2+(2分)
(2)① 正(2分), Fe - 2e-= Fe2+(2分)
② 2CuSO4+ 2H2O 2Cu + O2↑ + 2H2SO4 (2分) ③ 224(2分)
2Cu + O2↑ + 2H2SO4 (2分) ③ 224(2分)
(3)O2+4e-+2H2O = 4OH-(2分) 2CH3OH+4KOH+3O2= 2K2CO3 +6H2O(2分)
本题解析:(1)Fe3+与Cu发生氧化还原反应,离子方程式为2Fe3+ + Cu = 2Fe2+ + Cu2+。
(2)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-
本题难度:一般
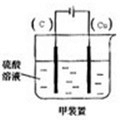
5、简答题 对下图中两极加以必要的连接并填空:
(1)在A图中,使铜片上冒出大量H2气泡.请加以必要连接.
写出负极上的电极反应式:______.
(2)在B图中,使b极析出Cl2,加以必要的连接后,该装置叫______.
总反应方程式:______.
经过一段时间后,溶液的pH值______(填升高、降低、不变)
(3)若将A、B串联(a接Cu,b接Zn),则a极析出的物质是______.当Zn片质量减少32.5g时,b极析出物质在标准状况下的体积为______?L.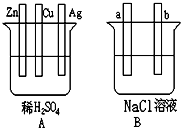
参考答案:在A图中,锌与稀硫酸反应,而铜和银与稀硫酸不反应,所以只能选锌作负极,根据题意知,铜作正极;
在B图中,使b极析出Cl2,溶液好氯离子失电子,所以该装置只能是电解池,b极上反应氧化反应,所以b极连接电源正极,a极两极电源负极.
故两装置图为:
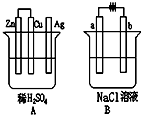
(1)通过上面分析知,锌作负极,锌失电子变成离子进入溶液,所以电极反应式为Zn-2e=Zn2+
故答案为:Zn-2e=Zn2+
(2)通过上面分析知,该装置为电解池,溶液中氯离子的放电能力大于氢氧根离子,所以在b电极上得氯气;氢离子的放电能力大于钠离子,所以在a极上得氢气,同时溶液中生成氢氧化钠,
所以电池反应式为2NaCl+2H2O?电解?.?H2↑+2NaOH+Cl2↑.
随着反应的进行,溶液中氢氧根离子的浓度越来越大,氢离子的浓度越来越小,所以溶液的PH值升高.
故答案为:电解池;2NaCl+2H2O?电解?.?H2↑+2NaOH+Cl2↑;升高.
(3)若将A、B串联,A是原电池,B是电解池,原电池中锌作负极,铜作正极;串联后,a接Cu,所以a是阳极,
b接Zn,b是阴极.a极上氯离子失电子生成氯气,b极上氢离子得电子生成氢气.根据串联时,各电极上得失电子数相等知,锌失去的电子等于生成氢气时得到的电子,
即n(Zn)×2=n(H2)×2.
32.5g6565g/mol×2=VL22.4L/mol×2
所以v=11.2
故答案为:Cl2;?11.2.
本题解析:
本题难度:一般