(5)有机物A可否发生缩聚反应?若能,请直接写出反应的化学方程式;若不能,请指出原因?
参考答案:(1)90;(2)0.30mol,5.4g;(3)C3H6O3;
(4)
(5)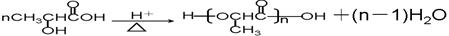
本题解析:(1)相同条件下,气体的密度之比是相应的化学计量数之比,所以A的相对分子质量是45×2=90。
(2)根据题意可知,碱石灰增加的质量包括水的质量以及部分CO2的质量。沉淀是碳酸钙,物质的量是0.1mol,4.48L无色无味气体是CO2,物质的量是0.2mol,则总的CO2是0.3mol。其中被碱石灰吸收的CO2的物质的量是0.2mol,质量是0.2mol×44g/mol=8.8g,所以生成物水的质量是14.2g-8.8g=5.4g,物质的量是0.3mol。A是9g,物质的量是0.1mol,则C、H的原子个数分别是3、6,所以氧原子的个数是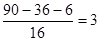 ,则A的分子式为C3H6O3。 ,则A的分子式为C3H6O3。
(3)0.1molA和碳酸氢钠反应生成0.1molCO2,说明分子中含有1个羧基。生成的氢气也是0.1mol,则分子中还含有1个羟基。由于酯化反应分别发生在链中和链端,所以结构简式为
CH3CHOHCOOH。
(4)A分子中含有羧基和羟基,所以能够发生缩聚反应,方程式为
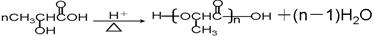 。 。
本题难度:一般
2、计算题 某仅由C、H、O三种元素组成的有机化合物,经测定相对分子质量为90,取该有机化合物样品1.8g,在纯氧中完全燃烧将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g,试通过计算求该有机化合物分子式并写出一种合理的结构简式。
参考答案:(10分)C3H6O3? CH3CH(OH)COOH等
本题解析:1.8g有机物的物质的量是1.8g÷90g/mol=0.02mol
浓硫酸增加的质量就是水的质量,则水的物质的量是1.08g÷18g/mol=0.06mol
碱石灰增加的质量是CO2,则CO2的质量是2.64g÷44g/mol=0.06mol
则1.8g有机物中氧原子的质量是1.8g-0.006mol×2×1g/mol-0.06mol×12g/mol=0.96g
氧原子的物质的量是0.96g÷16g/mol=0.06mol
所以该有机物的最简式是CH2O
又因为该有机物的相对分子质量是90
所以该有机物的分子式是C3H6O3
其中可能的结构简式是CH3CH(OH)COOH或HOCH2CH2COOH、HOCH2COOCH3等
点评:该题是中等难度试题的考查,侧重对基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理和规范答题能力。
本题难度:一般
3、选择题 等物质的量的下列有机物完全燃烧,生成CO2的量最多的是(? )
A.CH4
B.C2H6
C.C3H6
D.C6H6
参考答案:D
本题解析:在物质的量消相等的条件下,有机物中碳原子数越多,完全燃烧生成的CO2就越多,则根据有机物的化学式可知,D选项中碳原子数最多,生成的CO2最多,答案选D。
点评:该题是高考中额常见题型,属于中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是利用好原子守恒,另外还要特别注意的是要分清楚是物质的量相等,还是质量相等,然后结合题意和有关方程式灵活运用即可。
本题难度:简单
4、填空题 未知物A的实验式和分子式都是C2H6O。A的红外光谱图如图(a),未知物A的核磁共振氢谱有三个峰如图(b),峰面积之比是1∶2∶3,未知物A的结构简式为____________。
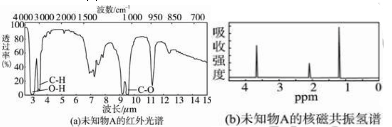
参考答案:CH3—CH2—OH
本题解析:据题意知:有三种峰,说明氢原子有三种情况,峰面积之比是1∶2∶3,说明这三种氢的个数之比为1∶2∶3。
本题难度:简单
5、计算题 (6分)由人尿分离出来的结晶化合物A,熔点为187~188℃。对化合物A做下列实验:
①测得A的蒸气密度为8.Og/L(已折合成标准状况)。
②取17.92gA完全燃烧,生成的气体通过浓硫酸,浓硫酸增重8.10g;剩余气体通过碱石灰,气体质量减少39.60g。
③另取17.92gA完全分解,可得标准状况下氮气1.12L。
试通过计算确定A的分子式。
参考答案:M(A)="8.0g" / L×22.4L / mol="179.2g" / mol(1分)
由题中数据计算知:0.1mol A可产生0.45mol H2O,0.9mol CO2和0.05mol N2(3分)
即1mol A 中含9mol C 9mol H 1mol N
设A的分子式为C9H9NOX
则:9×12+9+14+16x=179.2
∴x=3
∴A的分子式是C9H9NO3?(2分)
(其它合理的解法同样得分)
本题解析:考查有机物分子式的确定及相关计算。
本题难度:一般
|