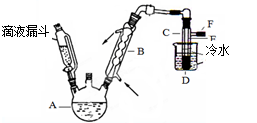
1、实验题 下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见表3:
?
| 乙醇
| 溴乙烷
| 溴
|
状态
| 无色
液体
| 无色
液体
| 深红棕色
液体
|
密度/g·cm-3
| 0.79
| 1.44
| 3.1
|
沸点/℃
| 78.5
| 38.4
| 59
|
?
表3.乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是?(选填序号)。
a.减少副产物烯和醚的生成? b.减少Br2的生成
c.减少HBr的挥发?d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式?。
(3)图中试管C中的导管E的末端须在水面以下,其原因是?。
(4)加热的目的是?。
(5)为除去产品中的一种主要杂质,最好选择下列?(选填序号)溶液来洗涤产品。
A.氢氧化钠? B.碘化亚铁? C.亚硫酸钠? D.碳酸氢钠
(6)第(5)步的实验所需要的玻璃仪器有?。
参考答案:B.[实验化学]
(1)a、b、c(2分)
(2)2HBr+H2SO4(浓) ?SO2+Br2+2H2O(2分)
?SO2+Br2+2H2O(2分)
(3)增加获得溴乙烷的质量(或减少溴乙烷的挥发)(2分)
(4)加快反应速率,蒸馏出溴乙烷(2分)
(5)C(2分)?
(6)分液漏斗、烧杯(2分)
本题解析:(1)乙醇与浓硫酸和溴化钠混合在一起,会发生乙醇的消去反应生成乙烯,乙醇分子间脱水生成醚,同时溴化钠会被浓硫酸氧化生成溴单质,由于浓硫酸具有吸水性当然也会使生成的HBr容易挥发出来等。因此在制备时要将浓硫酸进行适当稀释。
(2)运用氧化还原原理来书写:2HBr+H2SO4(浓) ?SO2+Br2+2H2O(2分)
?SO2+Br2+2H2O(2分)
(3)由于溴乙烷常温下是液体但其沸点仍是比较低的,易挥发通过用水冷却可增加获得溴乙烷的质量(或减少溴乙烷的挥发)。
(4)通过加热可加快反应速率同时有利于蒸馏出溴乙烷。
(5)产品中溶解了未反应的溴单质,选择氢氧化钠也会使溴乙烷损失,选择碘化亚铁同时又生成了碘杂质仍会溶解中其中,选择碳酸氢钠会有大量气泡关系会引发溴乙烷的挥发,最好选择亚硫酸钠,通过发生氧化还原反应生成了硫酸钠和溴化钠再通过分液较好分离。
(6)由第(5)的分析,最后要进行分液操作,所以用到的玻璃仪器有分液漏斗、烧杯
本题难度:困难
2、实验题 已知某醇燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收):
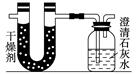
?
| 实验前
| 实验后
|
(干燥剂+U形管)的质量
| 101.1 g
| 102.9 g
|
(石灰水+广口瓶)的质量
| 312.0 g
| 314.2 g
|
?
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________ g,
假设广口瓶里生成一种正盐,其质量为________ g;
(2)生成的水中氢元素的质量为________ g;
(3)生成的二氧化碳中碳元素的质量为________ g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为__________,结构简式为_______________________________。
参考答案:(1)1.8 5 (2)0.2 (3)0.6 (4)3∶1
(5)CH4O CH3OH
本题解析:(1)m(H2O)=102.9 g-101.1 g=1.8 g
m(CO2)=314.2 g-312.0 g=2.2 g
则n(CaCO3)=n(CO2)=0.05 mol
m(CaCO3)=5 g
(2)m (H)=m(H2O)×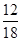 =1.8 g×
=1.8 g×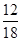 =0.2 g
=0.2 g
(3)m(C)=m(CO2)×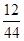 =2.2 g×
=2.2 g×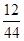 =0.6 g
=0.6 g
(4)m(C)∶m(H)=0.6 g∶0.2 g=3∶1
(5)该燃料分子中C、H的原子个数比为:
N(C)∶N(H)=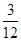 ∶
∶ =1∶4。
=1∶4。
据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1∶4时,分子中只能含CH4,而不能为CH4的整数倍,又因为每个分子中含有一个氧原子,则该醇的分子式为CH4O,结构简式为CH3OH。
本题难度:一般
3、推断题 由碳、氢、氧三种元素组成的某有机物,分子中共含有10个原子,其原子
核外共有32个电子,lmol该有机物在氧气中完全燃烧时需要4molO2,回答:
(1)求该有机物的分子式。
(2)若该有机物可使溴水褪色,但不发生银镜反应,取2mol该有机物与足量钠反应,
能产生22.4L H2(标准状况),则该有机物的结构简式可能是什么?
(3)若该有机物能发生银镜反应,则其结构简式是什么? 并写出该有机物发生银镜反应的化学方程式。
参考答案:(1) C3H6O? (2) CH=CH-CH2OH?(3) ?CH3CH2CHO?
CH3CH2CHO? + 2Ag(NH3)2OH  ?CH3CH2COONH4 + 2Ag + 3NH3 + H2O
?CH3CH2COONH4 + 2Ag + 3NH3 + H2O
本题解析:(1)设该有机物的分子式为CxHyOz,因为分子中共含有10个原子,所以x+y+z=10,其原子,核外共有32个电子,即6x+y+8z=32;lmol该有机物在氧气中完全燃烧时需要4molO2,故x+y/4-z/2=4,联立得到:
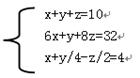 ,
,
解得,x=3,y=6,z=1,所以该有机物的分子式为:C3H6O;
(2)若该有机物可使溴水褪色,但不发生银镜反应,又有机物的分子式为:C3H6O,其不饱和度为1,所以该有机物含有碳碳双键,2mol该有机物与足量钠反应,能产生22.4L H2(标准状况),说明该有机物含有羟基,故该有机物的结构简式可能为CH=CH-CH2OH,(羟基不能连接在双键上的碳,这样的结构不稳定);(3)若该有机物能发生银镜反应,则该有机物含有醛基,所以其结构简式为:CH3CH2CHO,其发生银镜反应的化学方程为:
CH3CH2CHO? + 2Ag(NH3)2OH  ?CH3CH2COONH4 + 2Ag + 3NH3 + H2O。
?CH3CH2COONH4 + 2Ag + 3NH3 + H2O。
点评:本题考查了有机物分子式、结构简式的确定,本题综合性好,难度中等。
本题难度:一般
4、选择题 在20℃时,某气态烃与O2的混合气在密闭的容器中点燃爆炸后又恢复到20℃,此时容器内气体的压强变为反应前的一半,再经NaOH溶液吸收后,容器内几乎成真空,此烃的分子式可能是
A.C3H6
B.C2H2
C.C2H6
D.C3H8
参考答案:D
本题解析:经NaOH溶液吸收后,容器内几乎成真空,说明氧气和气态烃恰好反应,则根据燃烧通式CnHm+(n+m/4)O2=nCO2+m/2H2O可知,(1+n+m/4)÷2=n,解得n=1+m/4。根据有机物的分子式可知,只有选项D是正确的,答案选D。
本题难度:一般
5、计算题 在某一温度下,将20 g乙炔溶于40 g苯(C6H6)中,所得混合溶液中氢元素的质量分数是(? )
A.7.7%
B.7.9%
C.15.4%
D.15.8%
参考答案:A
本题解析:略
本题难度:简单