1、简答题 把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和).
(1)溶液中H+的物质的量浓度为______,SO42-的物质的量浓度为______.
(2)向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余.此时,溶液中的Fe2+物质的量浓度为______.
参考答案:(1)把2.0mol?L-1CuSO4和1.0mol?L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=12×1.0mol/L=1.0mol/L,c(H2SO4)=12×1.0mol/L=0.5mol/L,
混合后溶液中c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,溶液中硫酸根来源于硫酸铜与硫酸电离,故c(SO42-)=c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,
故答案为:1mol/L;1.5mol/L;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
故答案为:1.5mol/L.
本题解析:
本题难度:一般
2、选择题 配制一定物质的量浓度的NaOH溶液时,可造成所配溶液浓度偏高的是( )
A.所用NaOH已吸潮
B.向容量瓶滴加水时液面低于刻度线即摇匀
C.有少量NaOH溶液残留在烧杯内
D.向容量瓶加水时仰视液面
参考答案:B
本题解析:
本题难度:简单
3、选择题 体积为V?mL、密度为ρ?g/cm3的溶液,含有相对分子质量为M的溶质m?g,其物质的量浓度为c?mol/L,溶质的质量分数为W%,下列表示式中正确的是
A.c=
B.m=
C.W%=%
D.c=
参考答案:BD
本题解析:分析:根据溶液的质量为ρV,溶质的质量等于溶液的质量与质量分数的乘积,以及c= 来计算.
来计算.
解答:A.根据c=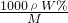 可知,c=
可知,c=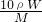 ,故A错误;
,故A错误;
B.溶液的质量为ρV,溶质的质量等于溶液的质量与质量分数的乘积,则m=ρV×W%=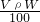 ,故B正确;
,故B正确;
C.质量分数等于溶质质量与溶液质量的比,则W%=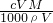 ×100%=
×100%=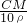 %,故C错误;
%,故C错误;
D.根据c= 可知,c=
可知,c= =
= ,故D正确;
,故D正确;
故选BD.
点评:本题考查物质的量浓度的有关计算,明确质量、物质的量、质量分数与物质的量浓度之间的关系及计算公式即可解答,难度不大.
本题难度:一般
4、选择题 把100g浓度为18mol?L-1、密度为ρ(g?cm-3)的浓硫酸加到一定量的水中稀释成9mol?L-1的硫酸,则加入水的体积( )
A.小于100mL
B.等于100mL
C.大于100mL
D.等于100/ρmL
参考答案:稀释前后溶质的质量不变,设加水的质量为x,
则100g×w1=(100g+x)×w2,
18mol?L-1的浓硫酸加到一定量的水中稀释成9mol?L-1的硫酸,
由c=1000ρwM及硫酸的浓度越大,密度越大,
则w1>w2,w1<2w2,
所以100+x100<2,
解得x<100g,
又水的密度约为1g/mL,
则加水的体积小于100mL,
故选A.
本题解析:
本题难度:简单
5、选择题 配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是( )
A.定容时观察液面仰视
B.将准确称量的NaOH固体溶于水后,立即转移入容量瓶内,再加蒸馏水至容量瓶刻度线
C.溶液从烧杯转移到容量瓶后未洗涤烧杯
D.容量瓶中原来有少量蒸馏水
参考答案:AC
本题解析:
本题难度:一般